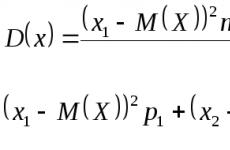Gökkuşağının renklerinin kimyasal reaksiyonları bir şişede. kimya hakkında ilginç
Yakıldığında parlak ve parlak beyaz veya renkli bir ateş veren maddelerin bir karışımı, Bengal Körfezi boyunca bulunan Hindistan'ın bir parçası olan Bengal'in eski piroteknikleri tarafından icat edildi. "Bengal ateşi" adı buradan geliyor. Hindistan'dan Bengal ışıkları veya Bengal mumları dünyaya yayıldı.
Satın alınan Bengal mumları, üzerine yanıcı bir karışımın uygulandığı bir telden oluşur ve genellikle Beyaz ateş. Renkli ev yapımı maytap hazırlamak için önce nişastayı suyla karıştırın ve kalın bir macun demleyin.
Daha sonra karışımı bir havanda öğütün. ütü talaş, alüminyum veya magnezyum toz, tuz, alevi renklendirme ve ıslak "bertolet tuzu" - potasyum klorat KClO3 ( Dikkatlice! Kuru potasyum klorat, ovulduğunda metal tozlarını tutuşturabilir!)
Sürtünerek elde edilen karışım nişasta hamuruna ilave edilir ve iyice karıştırılır. Kalın kütle bir test tüpüne veya uzun bir bardağa aktarılır, dönüşümlü olarak 8-10 cm derinliğe daldırılır, yaklaşık 1 mm kalınlığında önceden hazırlanmış demir teller çıkarılır ve fazla kütleyi boşaltmasına izin verilir ve daha sonra asılır. telin diğer ucunda bükülmüş bir kanca ile ip.
Kuruduktan sonra teller tekrar sıvı kütleye daldırılır ve tekrar kurutulur. Bu işlemler, tel üzerindeki kütle tabakası 5-6 mm çapa ulaşana kadar 3-5 kez tekrarlanır, ardından Bengal mumları tamamen kurutulur.
Yeşil Bengal ateşi 5 gr öğütmeden karıştırılarak elde edilir. ıslak baryum nitrat Ba (NO 3 ) 2 sn 1 gr alüminyum veya magnezyum toz, sonra 3 g ekleyin ütü talaş. Yeşil maytap için başka bir tarif 3.5g içerir borik asit B(OH) 3 , 6.5 gr ıslak potasyum klorat, 2 gr demir tozu ve 1 gr alüminyum tozu.
Kırmızı maytap 4.5 g karışım verir ıslak stronsiyum nitrat Sr (NO 3) 2, 5.5 gr potasyum klorat ben, 3 gr ütü talaş ve 1 gr alüminyum veya magnezyum pudra.
Sarı Bengal ateşi 3 gr'dan hazırlanırsa gözlerinizi şenlendirecektir. sodyum oksalat Na 2C 2 O 4, 5 gr ıslak potasyum klorat, 3 gr ütü talaş ve 1 gr alüminyum veya magnezyum pudra.
Bengal karışımlarının yanması sırasında renkli ateş, katyon içeren maddelerin varlığı nedeniyle elde edilir. baryum, stronsiyum, sodyum veya atomlar bor, yetenekli, aleve girme, spektrumun görünür bölgesinde belirli bir dalga boyunda ışık yayma. Ütü Fe, alüminyum Al ve magnezyum Yanan tozlar veya küçük talaş formundaki Mg, muhteşem kıvılcımlar verir. Bu durumda, demir oksit (III) Fe 2 O 3 ve kısmen Fe 3 O 4 ile Al 2 O 3 ve MgO oluşur.
Buradaki ana reaksiyon, KClO3 ile redoks etkileşimidir. nişasta, şartlı olarak C 6 H 10 O 5 formülü ile gösterilebilir:
4KClO 3 + C 6 H 10 O 5 \u003d 4 KCI+ 6CO 2 + 5H 2 O
baryum nitrat yeşil bir alevin ortaya çıkmasına neden olan, indirgeyici ajanların (demir, nişasta) varlığında ayrışır. baryum oksit, nitrojen dioksit ve oksijen:
2Ba(NO 3 ) 2 = BaO+ 4NO2 + O2
Benzer şekilde ayrışır stronsiyum nitrat aleve kırmızı bir renk verir.
sodyum oksalat karışım yandığında sodyum karbonat ve monoksit karbon:
Na 2 C 2 O 4 \u003d Na 2 CO 3 + CO
a borik asit B(OH) 3 , suyu serbest bırakır, bor oksit:
2B (OH) 3 \u003d B203 + 3H2O
Oksalatlar hakkında daha fazla bilgi
Oksalatlar - tuzlar oksalik asit H 2 C 2 O 4 . 2H 2 O, renksiz kristalli madde. Alkali metal ve amonyum oksalatlar, suda kolayca çözünen renksiz kristalli maddelerdir; kalan oksalatlar az çözünür.
Konsantre sulu çözeltilerindeki güçlü asitler, serbest bırakma ile oksalatları bu asitlerin tuzlarına ayrıştırır. monoksit ve karbon dioksit. Örneğin, sodyum oksalat konsantre etkisi altında Na 2 C 2 O 4 sülfürik asit dönüşür sodyum sülfat, CO ve CO 2 salınımı :
Na 2 C 2 O 4 + H 2 SO 4 = Na 2 SO 4 + CO + CO 2 + H 2 O
Oksalik asit iki baziktir ve iki dizi tuz oluşturur: ortam, örneğin potasyum oksalat monohidrat K 2 C 2 O 4 . H20 ve asidik - hidrooksalatlar, örneğin potasyum hidroksalat monohidrat KHC 2 O 4 . H 2 O. Isıtıldığında, hemen hemen tüm oksalatlar metal karbonatlar ve monoksit karbon CO. Yani, kalsiyum oksalat CaC 2 O 4 dönüşür kalsiyum karbonat ve monoksit karbon:
CaC 2 O 4 \u003d CaCO 3 + CO
Daha güçlü ısıtıldığında CaCO 3 açığa çıkar. karbon dioksit CO 2, dönüşerek kalsiyum oksit CaO:
CaCO 3 \u003d CaO + CO 2
Sulu çözeltilerdeki oksalatlar indirgeyici özellikler sergiler. Örneğin, etkileşim sodyum oksalat asidik bir ortamda potasyum permanganat serbest bırakmaya yol açar karbon dioksit:
5Na 2 C 2 O 4 + 2KMnO 4 + 8H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 10CO 2 + 5Na 2 SO 4 + 8H 2 O
"Bengal Kağıt"
Bengal kağıdı tutuşturulduğunda renkli bir alevle yanar, duman oluşturmaz ve pratik olarak kokusuzdur. Hazırlamak için, filtre şeritleri, tuvalet veya peçete kağıdı, aşağıdaki tariflere göre yanma için gerekli oksijeni serbest bırakan ve alevi renklendiren sulu bir tuz çözeltisi ile emprenye edilir:
· 2 ml çözelti etil alkol, 2 gr baryum klorat ve 2 gr potasyum klorat 10 ml su içinde (kağıt yeşil bir alevle yanacaktır);
· 2 ml çözelti etil alkol, 2 gr stronsiyum nitrat ve 1 gr potasyum klorat 10 ml su içinde (alevin rengi kırmızıdır);
· 2 ml çözelti etil alkol, 2 gr bakır nitrat ve 1 gr potasyum klorat 10 ml su içinde (alev mavi olacaktır).
· 2 ml çözelti etil alkol, 1 gr sodyum oksalat ve 1 gr potasyum klorat 10 ml su içinde (alev sarı renk).
Çözelti emdirilmiş yapıştırılmamış kağıt şeritleri havada kurutulur ve ardından ateşe verilir. Gösteri unutulmaz!
Bir bardakta Buran
500 ml'lik bir behere 5 g benzoik asit dökün ve bir dal çam yerleştirin. Bardağı soğuk suyla porselen bir kap ile kapatıyoruz ve bir alkol lambasının üzerinde ısıtıyoruz. Asit önce erir, sonra buhara dönüşür (buharlaşır) ve cam dalı beyaz pullarla kaplayan "kar" ile doldurulur.
yanan kar
Demir bir teneke kutuya kar döküyoruz ve hafifçe sıkıştırıyoruz. Sonra içine bir girinti yaparız (kutunun yüksekliğinin yaklaşık ¼'ü), oraya küçük bir parça kalsiyum karbür koyun ve üstüne karla örtün. Kar için yanan bir kibrit getiriyoruz - "kar yanıyor" bir alev belirecek.
Kalsiyum karbür, ateşlendiğinde yanan asetilen oluşturmak için karla yavaş yavaş reaksiyona girer.
CaC 2 + 2H 2 O® Ca(OH)2 + C2H2.
2C 2 H 2 + 5O 2 ® 4CO 2 + 2H 2 O + Q.
Bir bardakta fırtına
Bir bardak suda "Gök gürültüsü" ve "şimşek"!
Önce 5-6 g potasyum bromat KBrO3 ve 5-6 g baryum klorür dihidrat BaCl2 2H2O tartın ve bu renksiz kristal maddeleri 100 g damıtılmış suda ısıtıldığında çözün ve ardından elde edilen çözeltileri karıştırın. Karışım soğutulduğunda, soğukta az çözünür olan bir baryum bromat B çökeltisi çökecektir. a(BrO3)2:
2KBrO3 + BaCl2 = B a(ВrО3)2Ї + 2KCl.
Çöken renksiz kristalleri süzün B a(BrO3)2 ve küçük (5-10 ml) porsiyonlarla 2-3 kez yıkayın. soğuk su. Ardından yıkanmış çökeltiyi havayla kurutun. Bundan sonra, elde edilen B'nin 2 g'ı a(BrO3)2'yi 50 ml kaynar suda çözün ve hala sıcak olan çözeltiyi süzün.
40–45 °C'ye soğutmak için süzüntü içeren bardağı yerleştirin. Bu en iyi şekilde aynı sıcaklığa ısıtılmış bir su banyosunda yapılır. Bir termometre ile banyonun sıcaklığını kontrol edin ve eğer düşerse, elektrikli bir ocak ile suyu tekrar ısıtın.
Pencereleri perdelerle kapatın veya ışığı kapatın, böylece oda alacakaranlıkta olur ve camda, kristallerin görünümüyle aynı anda bir yerde mavi kıvılcımların nasıl görüneceğini göreceksiniz - "yıldırım" ve patlamalar "gök gürültüsü" duyulacak. İşte bir bardakta bir "fırtına"!
Işık etkisi, kristalizasyon sırasında enerjinin serbest bırakılmasından kaynaklanır ve patlamalar, kristallerin görünümünden kaynaklanır.
"Altın" çıkarılması
ile bir şişede sıcak su kurşun asetatı çözün ve diğerinde - potasyum iyodür. Her iki çözelti de büyük bir şişeye dökülür, karışımın soğumasına ve çözelti içinde yüzen güzel altın pullar göstermesine izin verilir.
Pb (CH3COO) 2 + 2KI = PbI2 + 2CH3COOK
Mineral "bukalemun". 3 ml doymuş potasyum permanganat çözeltisi ve 1 ml %10 potasyum hidroksit çözeltisi bir test tüpüne dökülür. Ortaya çıkan karışıma 10-15 damla sodyum sülfit solüsyonu koyu yeşil renk görünene kadar çalkalanarak eklenir. Karıştırıldığında çözeltinin rengi maviye, sonra mora ve son olarak ahududuya döner.
Koyu yeşil rengin görünümü, potasyum manganat K2MnO4 oluşumu ile açıklanır:
2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + Na2SO4 + H2 O.
Çözeltinin koyu yeşil rengindeki değişiklik, potasyum manganatın atmosferik oksijenin etkisi altında ayrışmasından kaynaklanmaktadır:
4K2MpO4 + O2 + 2H2O = 4KMpO4 + 4KON.
Ateşsiz duman
Alevsiz ve ateşsiz yanan maddelerin bir sonucu olarak sis perdeleri, bir konser sahnesinde veya eğlenceli bir tarihi film veya aksiyon filmi çekerken muhteşem duman üflemeleri - tüm bunlar kimyagerlerin işidir.Genellikle, bu tür etkileri yaratmak için, havadaki en küçük katı duman veya sis parçacıklarını oluşturan kolayca tutuşabilen maddeler kullanılır.
Bu davranış, örneğin parafin, amonyum klorür, naftalin için tipiktir.
"Sigara" bileşiklerinden biri 5 g karıştırılarak hazırlanır. amonyak(amonyum klorür), 2 gr naftalin, 2 gr berthollet tuzu(potasyum klorat) ve 1 gr odun kömürü. Böyle bir karışımı ateşe vermek sadece açık havada, çünkü yanarken, alevsiz yoğun duman oluşur, kötü koku amonyak ve naftalin.
Kapalı bir odada dumanı göstermek istiyorsanız, bir bardağı birkaç damla hidroklorik asitle içeriden nemlendirmeniz ve ters çevirerek nemlendirilmiş bir pamuk yünü ile örtmeniz gerekir. amonyak. Camın tüm iç kısmı, ortaya çıkan amonyum klorürden hemen beyaz dumanla doldurulacaktır. Seyirciyi benzeri görülmemiş bir deneyimle etkilemek için sudan duman alabilirsiniz. Bunu yapmak için, bir bardağa su dökün ve bir parça "kuru buz" atın - katı karbon dioksit. Su hemen kaynar ve soğutulmuş su buharlarından oluşan kalın beyaz bir duman bardaktan dışarı dökülür. Bu duman tamamen güvenlidir.
Alevsiz yanma, katalizörler (kimyasal reaksiyonların hızlandırıcıları) kullanılarak elde edilebilir, örneğin, krom oksit(III)Kr 2O3 . Bu, birçok ucuz boyada pigment olarak kullanılan yeşil bir tozdur. Alevsiz yanma şu şekilde gösterilir: seramik bir karo üzerine metal bir kap yerleştirilir, burada yanan bir mumdan biraz damlar parafin, stearin veya balmumu ve hemen soğumamışken üzerine Cr tozu dökülür. 2O3 . Erimiş parafinin tozu sadece alttan emmesi ve üst krom oksit tabakasının kuru kalması gerekir. Şimdi, tepenin tepesine yanan bir kibritle dokunursanız, bol duman emisyonu başlayacak, ancak kimse alevi görmeyecek. Parafinin yanma reaksiyonunda çok fazla ısı açığa çıkar, bu nedenle yavaş yavaş erir ve kılcal kuvvetlerin etkisi altında tepenin tepesine yükselir, buharlaşır ve katı parafin parçacıklarından oluşan duman oluşturur.
Krom oksit ayrıca maddenin alevler ve duman olmadan gizemli bir şekilde ortadan kayboluşunu göstermeye yardımcı olacaktır. Bunu yapmak için, bir slaytta birkaç tablet "katı alkol" (kuru yakıt) istifleyin ve üstüne bir tutam önceden ısıtılmış Cr dökün. 2O3 . Bir süre sonra tüm slayt bir tutam yeşil toza dönüşecektir. Oksidasyon ürotropin-- bir katalizör varlığında katı alkol bazları, tüm yanma ürünlerinin gaz halinde olduğu reaksiyona göre ilerler. Çözeltiye batırılmış bir kağıt şeridi kurşun asetat ve havada kurutulur, ayrıca alevsiz yanar; o sadece için için yanıyor. Bu, kurşun asetatı kurşun oksit ve öne çık karbon dioksit.
Son olarak, bir bardağa 10-15 ml döküldüğünde bir maddenin dumansız ve alevsiz yanması gösterilebilir. aseton(Dikkatlice! Aseton yanıcıdır! ve kızgın bakır teli sıvının yüzeyine değmeyecek şekilde oraya indirin. Bakır tel, tüm aseton tükenene kadar parlayacaktır. Deneyimi daha da muhteşem kılmak için odadaki ışıklar kapatılır. Bakırın (katalizör görevi gören ve reaksiyonu hızlandıran) yüzeyinde aseton buharı oksitlenir. asetik asit ve asetaldehit vurguyla Büyük bir sayı sıcaklık.
ayna şişesi
Aynalar çağımızdan çok önce ortaya çıktı. İlk başta, altın, gümüş, bakır ve ayrıca bronz - bakır ve kalay alaşımından yapılmış bir parlaklığa cilalanmış metal plakalardı. Kroniklere göre, bronz aynaların yardımıyla Arşimet MÖ 212'de. “Syracuse savaşında kadın gemilerini yaktı. ayna yapımı modern tip(cam üzerinde) 1858'de Alman kimyager Justus von Liebig tarafından başlatıldı.
Liebig şunları yaptı. Şişenin iç yüzeyini bir soda - sodyum karbonat Na2C03 çözeltisi ile yağdan arındırdıktan sonra, su, etil alkol C2H5OH ve dietil eter (C2H5) 2O ile yıkadı. Bundan sonra, Liebig şişeye birkaç mililitre %10 sulu formaldehit HCHO (formalin) çözeltisi döktü. Karışıma OH bileşiminin bir gümüş amonyum kompleksi çözeltisini ekledikten sonra, şişeyi dikkatlice ısıttı ve birkaç dakika sonra aynaya benzer hale geldi (gümüş, duvarlarda ince bir kaplama şeklinde göze çarpıyordu). şişe). Daha sonra, formalin yerine Liebig, bir “gümüş ayna” elde etmek için %10 glikoz çözeltisi С6Н12О6 kullanmaya başladı.
Liebig'in deneyini tekrarlamaya çalışın, sadece açıklamasını aynen takip edin.
Gümüş - diamin gümüş (I) hidroksit (Ag (NH3) 2OH) amonyak kompleksinin bir çözeltisini hazırlamak için, 100 ml su içinde % 25'lik bir gümüş nitrat AgNO3 çözeltisi damla damla eklenir su çözümü amonyak NH3 başlangıçta çökelen gümüş oksit Ag2O çökeltisine kadar kompleks bir tuz şeklinde çözeltiye girer. Aşağıdaki reaksiyonlar gerçekleşir:
2AgNO 3 + 2NH3 + H20 = Ag 2O ¯ + 2N H4N O3,
Ag2O + 4NH3 + H20 = 2[A g(NH3)2]OH.
Bir "gümüş ayna" elde etmek için reaksiyon denklemi aşağıdaki gibidir:
2OH + HCHO = 2Ag¯ + HCOONH4 + 3NH3 + H20.
Kompleks katyon metal Ag'ye indirgenir ve formaldehit HCHO, formik asit HCOOH'ye oksitlenir, bu da fazla amonyak varlığında bir tuz - amonyum format HCOONH4'e dönüşür:
HCOOH + NH3 = HCOONH4
Bir "gümüş ayna" oluşumuna neden olan reaksiyonlar daha sonra bir çözeltideki aldehitlerin ve glikozun kalitatif tespiti için kullanıldı ve gümüş kompleksi bileşiğinin çözeltisinin kendisine Alman kimyager Bernhard Tollens'ten sonra "Tollens reaktifi" adı verildi, 1881'de bu bileşiği analitik kimyada kullanmayı öneren kişi.
köpüklü kristaller
Beyaz ışık
108 g karıştırmayı deneyin potasyum sülfat ve 100 gr dekahidrat sodyum sülfat(Glauber tuzu) ve tüm kristaller eriyene kadar biraz sıcak kaynamış su karıştırarak porsiyonlar halinde ekleyin. Çift tuzu soğutmak ve kristalleştirmek için çözeltiyi karanlıkta bırakın. Kristaller öne çıkmaya başlar başlamaz, çözüm parlayacak: 60'ta ÖİTİBAREN zayıf, ama soğudukça güçleniyor ve güçleniyor. Bir sürü kristal düştüğünde, bütün bir kıvılcım demeti göreceksiniz. Kabın dibindeki ayrılmış kristallerin üzerinden bir cam çubuk geçirirseniz tekrar kıvılcımlar çıkacaktır. Parlama ve kıvılcım, kristalizasyon sırasında çift tuz bileşim Na2S04. 2K2SO4. 10H 2 O, neredeyse tamamen ışığa dönüşen çok fazla enerji yayar.
turuncu ışık
Bu aynı zamanda bir kimyasal reaksiyonun enerjisinin ışığa neredeyse tamamen dönüştürülmesinin sonucudur. Bunu gözlemlemek için doymuş sulu bir çözeltiye dökün. hidrokinon%10-15 çözüm potasyum karbonat, formalin ve perhidrol. Sıvının parıltısı en iyi karanlıkta gözlenir. Parıltı, hidrokinonu kinona ve formaldehiti formik aside dönüştüren redoks reaksiyonlarından kaynaklanır. Aynı zamanda, formik asidin potasyum karbonat ile nötralizasyon reaksiyonu, karbondioksit salınımı ile ilerler ve çözelti köpürür.
kırmızı prizmalar
10 gr dikromat potasyum, 40 ml konsantre hidroklorik asit ile karıştırılır ve 15-20 ml su ilave edilir. Karışımı biraz ısıtırız ve tuz kristalleri çözeltiye girer. dağıldıktan sonra dikromat potasyum çözeltisi su ile soğutulur. Potasyum tuzları olan prizmalar şeklinde çok güzel kırmızı kristaller düşer. klorokromik asit asitler KCrO 3 Cl, reaksiyon denklemine göre:
K 2 Cr 2 O 7 + 2 HCl® 2 KCrO 3 Cl+ H2O.
Beyaz maddenin kırmızı çökeltisi
baryum sülfat BaSO 4 suda çözünmeyen ağır beyaz bir tozdur. Bu, tüm kimyagerler tarafından bilinir ve bu nedenle tüm referans kitaplarında ve kimya kitaplarında açıklanmıştır. Ama burada renksiz bir çözüm aldın potasyum sülfat Menekşe ile K 2 SO 4 potasyum permanganat KMnO 4, buna bir çözüm ekledi baryum klorür ve sürpriz bir şekilde, kırmızı bir çökeltinin düştüğünü gördüler. Potasyum permanganatı uzaklaştırmak için kırmızı çökeltiyi yıkamak sonuç vermez, çökelti kırmızı kalır. Kırmızı çökelti saf baryum sülfat değil, kesin çözüm Baryum sülfatın kristal kafesinde sülfat iyonlarının bir kısmının değiştirildiği BaSO 4'teki KMnO 4 permanganat iyonları. Böyle bir çökeltinin suyla en kapsamlı yıkamada bile renginin değişmeyeceği açıktır.
Kaşık... kaybolur.
Bazen, bize çok iyi biliyormuş gibi görünen en sıradan nesneler ve maddeler, tuhaf kimyasal dönüşümlere uğrarlar. Alüminyum pişirme kaplarının onlarca yıl dayandığını kim bilmiyor? Ama bazen onun başına inanılmaz şeyler gelir: kelimenin tam anlamıyla gözlerimizin önünde kaybolur.
Alüminyum bir kaşık alın ve ince taneli zımpara kağıdı ile dikkatlice temizleyin ve ardından 5-10 dakika asetona batırarak yağdan arındırın. (CH3)2CO. Bundan sonra kaşığı birkaç saniye 100 ml su içinde 3,3 g Hg (NO3) 2 içeren cıva (II) nitrat çözeltisine daldırın. Bir Hg (NO3) 2 çözeltisindeki alüminyum yüzeyi grileşir olmaz, kaşık çıkarılmalı, kaynamış su ile yıkanmalı ve kurutulmalı, kurutulmalı, ancak silinmemeli, filtre veya tuvalet kağıdı ile. Mucizeler gözlerimizin önünde başlayacak: metal bir kaşık yavaş yavaş beyaz kabarık pullara dönüşecek ve yakında ondan sadece sıradan grimsi bir “kül” yığını kalacak.
Ne oldu? Alüminyum kimyasal olarak aktif bir metaldir. Genellikle karmaşık bir kimyasal kombinasyonda oksit ve moleküler oksijen içeren ince bir yüzey filmi ile atmosferik oksijenden ve nemden korunur. Alüminyumu cıva tuzu ile işleyerek yeni bir koruyucu filmin oluşmasını engelledik. Bunun nedeni, bir cıva (II) nitrat çözeltisinde bulunan alüminyumun, metalik cıvayı tuzdan uzaklaştırması (geri yüklemesi):
2А1 + 3Hg(NO3)2 = 3Hg¯ + 2А1(NO3)3
ANCAK ben+ Hg = (Al, Hg).
Kaşığın temizlenmiş yüzeyinde, alüminyumun atomik bir duruma ezildiği ince bir alüminyum amalgam tabakası (alüminyum ve cıva alaşımı) belirir. Amalgam, metal yüzeyi oksidasyondan korumaz ve kabarık alüminyum metahidroksit pullarına dönüşür:
4(A1, Hg) + 2H20 + 3O2 = 4AlO(OH) ¯ + 4Hg¯
Bu reaksiyonda tüketilen alüminyum, cıva içinde çözünen metalin yeni kısımları ile doldurulur ve salınan cıva, alüminyumu tekrar "yutturur". Ve şimdi, parlak bir alüminyum kaşık yerine, kalıyorlar. bir lo(OH) ve beyaz alüminyum metahidroksit pullarında kaybolan en küçük cıva damlacıkları.
Bir cıva (II) nitrat çözeltisinden sonra, bir alüminyum kaşık hemen damıtılmış suya batırılırsa, metalin yüzeyinde gaz kabarcıkları ve beyaz madde pulları görünecektir. Bunlar hidrojen ve meta-alüminyum hidroksittir:
2A1 + 4H2O \u003d 2AlO (OH) + ZH2.
Alüminyum, sulu bir bakır(II) klorür CuCl2 çözeltisinde benzer şekilde davranır. Temizlenmiş ve yağdan arındırılmış bir alüminyum plakayı bu solüsyona indirmeyi deneyin. Kahverengi metalik bakır pullarının oluşumunu ve gaz kabarcıklarının salındığını göreceksiniz.
Bakırın izolasyonu anlaşılabilir - kimyasal olarak daha aktif alüminyum metali bakırı tuzlarından geri yükler:
2А1 + 3CuCl2 = 3Cu¯ + 2А1С13.
Ama gaz salınımını nasıl açıklayabilirim? Bu durumda, koruyucu filmin alüminyum yüzeyinde oluşmaya zamanı olmadığı ve hidrojeni sudan çıkarmaya ve alüminyum metahidroksite dönüşmeye başladığı ortaya çıkıyor.
fosforlar
Luminoforların hazırlandığı maddeler önceden tamamen saflaştırılmalı (örneğin yeniden kristalleştirme yoluyla) veya yüksek bir saflık niteliğine sahip olmalıdır (örneğin, "kimyasal olarak saf" veya "yüksek saflık" - "kimyasal olarak saf" veya "ekstra saf"). Işıltılı bileşiklerden bazılarını hazırlamak için tarifler burada.
mor parıltı: kalsiyum karbonat (20 g), magnezyum karbonat (1.2 g), sodyum sülfat (1.0 g), potasyum sülfat (1.0 g), kükürt (6,0 g), sakaroz (1,0 g), bizmut(III) nitrat (1 ml 0,5 % çözüm); porselen havanda öğütün ve 750-800 °C'de 45 dakika pişirin.
Yeşil parıltı: kalsiyum karbonat (20 gr), sodyum sülfat (1.0 gr), sodyum tetraborat (0,8 gr), kükürt (6,0 gr), sukroz (0,8 gr), bizmut(III) nitrat (1 ml %5 solüsyon); porselen havanda öğütün ve 800-900 °C'de 15 dakika pişirin.
Mavi-yeşil parıltı: kalsiyum karbonat (4 gr), magnezyum karbonat (2 gr), stronsiyum karbonat (16 gr), sodyum sülfat (0,8 gr), sodyum tetraborat (0,5 gr), kükürt (6,0 gr), sukroz (0,3 gr), bizmut (III) nitrat (1 ml %0.5'lik çözelti); porselen havanda öğütün ve 650-700 °C'de 60 dakika pişirin.
Mavi parıltı: kalsiyum karbonat (4.0 g), magnezyum karbonat (4.0 g), sodyum sülfat (1.4 g), çinko oksit (6.0 g), baryum sülfür (3.0 g), kükürt (8.0 d) amonyum perklorat (8.0 g), sakaroz (1.0) g); porselen havanda (NH4ClO4 olmadan) öğütün, NH4ClO4 ile dikkatlice karıştırın ve alevde tutuşturun gaz brülörü 15 dakika içinde.
Parlak yeşil parıltı: magnezyum karbonat (4.0 g), sodyum sülfat (2.4 g), çinko oksit (6.0 g), baryum sülfür (4.0 g), kükürt (7.0 g), amonyum perklorat (10.4 d) sakaroz (0.8 g); porselen havanda (NH4ClO4'süz) öğütün, NH4ClO4 ile dikkatlice karıştırın ve gaz brülörü alevinde 15 dakika tutuşturun.
Yeşil parıltı: stronsiyum karbonat (2,0 g), magnezyum karbonat (4,0 g), sodyum sülfat (2,4 g), çinko oksit (6,0 g), baryum sülfür (2.0 g), kükürt (7.0 d), amonyum perklorat (8.0 g), sakaroz ( 0.8 gr); porselen havanda (NH4ClO4'süz) öğütün, NH4ClO4 ile dikkatlice karıştırın ve gaz brülörü alevinde 15 dakika tutuşturun.
Karışımlar morötesi ışınlar veya kamera flaşı ile aydınlatılır, ardından karanlıkta parlamaları gözlemlenir.
Borik asit bazlı fosforlar
Ekipman: seramik buharlaştırma kabı, borik asit (H3BO3), bazı bileşenler (aşağıya bakın), ruh lambası, el feneri.
2'yi buharlaşan bardağa koyun gr toz borik asit (eczanede satılır) ve aynı miktarda bileşen; Karıştırırken kalın bir bulamaç elde etmek için biraz su ekleyin. Ardından ısıtmaya başlayın. Önce karışım kaynamaya başlayacak, sonra su buharlaşacak ve bir kek çıkacak, sonra erimeye başlayarak reçineye dönüşecek. Bütün pasta bitene kadar bekleyin kalın camsı kütle ve ardından bardağı ocaktan alın ve soğumaya bırakın. Karışım soğur soğumaz, ortaya çıkan fosfor bir fotoğraf flaşı ile aydınlatıldığında (mutlak karanlıkta) bir parıltı gözlemlenebilir.
Borik asit ile kullanılan bileşenler
%0,1 floresan solüsyonu (parlak yeşil parıltı)
%10 nikel asetat çözeltisi (yeşil parıltı)
Sitrik asit (sarı parıltı)
Oksalik asit (salata kızdırma)
yanmaz mendil
Mendil, bir sodyum silikat çözeltisi ile emprenye edilir, kurutulur ve katlanır. Yanmazlığı göstermek için alkolle nemlendirilir ve ateşe verilir. Mendil, pota maşası ile düz bir şekilde tutulmalıdır. Alkol yanar ve sodyum silikat emdirilmiş kumaş zarar görmeden kalır.
Bir şişeden bulut
Sıradan bir şişe, uzaya bütün bir duman bulutu yayar. böyle gidiyor .AT büyük bir şişe kristalle doldurulur potasyum karbonat 1-2 cm tabaka ve dikkatlice %10 sulu çözelti dökün amonyak kristalleri kaplayan tabakası 2 mm'den daha kalın olmayacak şekilde. Daha sonra, çok ince bir akışta, biraz konsantre dökün. hidroklorik asit. Kendi ağırlığı altında dış duvarları boyunca kayan, masanın yüzeyi boyunca yayılan ve kenara ulaştıktan sonra yavaşça pullar halinde zemine düşen şişenin boynundan yoğun bir beyaz duman jeti kaçar. Beyaz dumanın görünümüne reaksiyonlar neden olur:
NH3+ HCl= NH4 Cl,
K2CO3 + 2 HCl
= 2KCI+ CO 2 + H 2 O
sprey kutusuİlk reaksiyonla elde edilen amonyum klorürün (küçük kristallerden oluşan bir hava süspansiyonu), ikinci reaksiyon tarafından salınan karbon dioksit ile şişeden taşınır. Karbondioksit havadan ağırdır ve bu nedenle "duman" yere düşer.
su altında ateş
1808'de İngiliz kimyager Humphry Davy (1778-1829) metalik magnezyum elde eden ilk kişiydi. (O zamanlar bu metalin özellikleri hakkında hiçbir şey bilinmiyordu.) Elde edilen magnezyum parçaları yanlışlıkla alev alınca Davy onları suyla söndürmeye başladı. Yüzünü yakan bir flaş oldu.
Bu deneyimi güvenli hale getirelim. Önümüze şeffaf bir pleksiglas ekran koyuyoruz ve koruyucu koyu renkli gözlükler takıyoruz (göz kamaştırıcı beyaz alevle magnezyum yanıkları). Ekranın arkasına bir bardak su koyun. Metal bir kaşıkta biraz (en fazla 2-3 g) magnezyum Mg tozu yakarız ve kaşığı hızla yanan magnezyumla suya indiririz. (Tabii kaşığın sapı uzun olmalı.)
Yanan magnezyum suya değdiği anda kaynar. Serbest kalan hidrojen tutuşabilir ve su yüzeyinin üzerinde yanabilir. Sudaki magnezyum, havadakinden daha parlak bir alevle yanacak ve etrafındaki su bulanıklaşmaya başlayacaktır.
Bu deneyim başka bir şekilde gerçekleştirilebilir. Porselen bir kapta 2-3 gr magnezyum tozunu yakalım ve ardından uzun bir pipet kullanarak bardağa 5-10 ml su dökelim. Hemen kör edici bir flaş olacak.
Magnezyum reaktif bir metaldir. Yanan magnezyum suyu ayrıştırır, açığa çıkan hidrojen havada tutuşur ve suda magnezyum hidroksit Mg (OH) 2 oluşur:
Mg + 2H20 \u003d Mg (OH) 2 + H2.
Yanan magnezyum su veya kumla söndürülemez. Sonuçta kum, su gibi, magnezyum oksit ve amorf silikon Si oluşturmak için yanan magnezyum ile etkileşime girecek olan silikon dioksit SiO2'dir:
SiO2 + 2Mg = Si + 2MgO.
Sadece yanan magnezyumun üzerine konan asbestli paspaslar ve asbestli battaniyeler alevleri söndürebilir.
Kırmızı fosforu beyaza çevirmek
Kuru bir deney tüpüne bir cam çubuk indirilir ve yarım bezelye miktarında kırmızı fosfor konur. Test tüpünün altı çok sıcaktır. İlk olarak, beyaz duman var. Daha fazla ısıtma ile, test tüpünün soğuk iç duvarlarında sarımsı beyaz fosfor damlacıkları belirir. Aynı zamanda bir cam çubuk üzerinde biriktirilir. Test tüpünün ısıtılması durdurulduktan sonra cam çubuk çıkarılır. Üzerinde beyaz fosfor tutuşur. Bir cam çubuğun ucuyla, test tüpünün iç duvarlarından da beyaz fosfor çıkarılır. Havada ikinci bir flaş var. Kaputun altında çok dikkatli bir şekilde gerçekleştirme deneyimi!
Şeker yanıyor
Maşa ile bir parça rafine şeker alın ve ateşe vermeye çalışın - şeker yanmaz. Bu parça bir sigaradan gelen küllerle serpilir ve ardından bir kibritle ateşe verilirse, şeker parlak mavi yanar alevlenir ve çabuk söner. (Küller, katalizör görevi gören lityum bileşikleri içerir.)
gizli mürekkep
 Kabul etmeliyiz ki, bazı mürekkep türleri ya uzun zaman önce ortadan kalktı ya da sadece gizli yazışmalar gibi gizemli amaçlar için kullanıldı. Bu tür kriptografi yazmanın birçok yolu vardır ve hepsi gizli veya "sempatik" mürekkep - renksiz veya hafif renkli sıvılar kullanır. Yazdıkları mesajlar ancak ısıtıldıktan, özel reaktiflerle işlendikten sonra veya ultraviyole veya kızılötesi ışınlarda görünür hale gelir. Bu tür mürekkep için birçok tarif var.
Kabul etmeliyiz ki, bazı mürekkep türleri ya uzun zaman önce ortadan kalktı ya da sadece gizli yazışmalar gibi gizemli amaçlar için kullanıldı. Bu tür kriptografi yazmanın birçok yolu vardır ve hepsi gizli veya "sempatik" mürekkep - renksiz veya hafif renkli sıvılar kullanır. Yazdıkları mesajlar ancak ısıtıldıktan, özel reaktiflerle işlendikten sonra veya ultraviyole veya kızılötesi ışınlarda görünür hale gelir. Bu tür mürekkep için birçok tarif var.
Korkunç İvan'ın gizli ajanları raporlarını soğan suyuyla yazdı. Kağıt ısıtıldığında harfler görünür hale geldi. Lenin gizli yazı yazmak için limon suyu veya süt kullandı. Bu durumlarda yazıyı geliştirmek için kağıdı sıcak bir ütüyle ütülemek veya birkaç dakika ateşte tutmak yeterlidir.
Ünlü casus Mata Hari de gizli mürekkep kullandı. Paris'te tutuklandığında, otel odasında bir şişe su çözeltisi bulundu. kobalt klorür, casusluk faaliyetleri ortaya çıktığında kanıtlardan biri haline geldi. Kobalt klorür kriptografi için başarıyla kullanılabilir: 25 ml su içinde 1 g tuz içeren solüsyonuyla yazılan harfler tamamen görünmezdir ve kağıt hafifçe ısıtıldığında maviye dönerek görünür.
Gizli mürekkep, Rusya'da yeraltı devrimcileri tarafından da yaygın olarak kullanıldı. 1878'de Vera Zasulich, St. Petersburg belediye başkanı Trepov'a ateş etti. Zasulich bir jüri tarafından beraat etti, ancak jandarma adliyeden ayrılırken onu tekrar tutuklamaya çalıştı. Ancak, kararı ne olursa olsun, yargılamanın sonunda arkadaşlarına kaçma planını önceden bildirerek kaçmayı başardı. Giysilerden bazılarının getirilmesini isteyen bir not, kağıdın arkasına sulu bir solüsyonda yazılmış bilgileri içeriyordu. Demir klorür FeCl 3 (Zasulich bu maddeyi ilaç olarak aldı). Böyle bir not, seyreltik bir sulu çözelti ile nemlendirilmiş bir pamuklu çubukla işlenerek okunabilir. tiyosiyanat potasyum: Demir tiyosiyanat kompleksi oluşumu nedeniyle tüm görünmez harfler kan kırmızısına döner.
Gizli örgüt "Black Repartition" üyeleri de yazışmalarında görünmez mürekkep kullandı. Ama birinin ihaneti yüzünden Çernoperedeltsy mektupları deşifre etmenin sırrını bilen hemen herkes tutuklandı... göztaşı. Kağıt bir şişe şişenin üzerinde tutulursa, böyle bir mürekkeple yazılmış bir metin ortaya çıktı. amonyak. Harfler parlak boyalı Mavi renk bir amonyak bakır kompleksi oluşumu nedeniyle.
Ancak Çin Seddi'nin saltanatı sırasında ortaya çıkan Çin imparatoru Qing Shi Huangdi (MÖ 249-206), yazılı hiyeroglifleri kuruttuktan sonra görünür bir iz bırakmayan gizli mektupları için kalın pirinç suyu kullandı. Böyle bir mektup zayıf bir alkol çözeltisiyle hafifçe nemlendirilirse iyot, mavi harfler görünür. Ve imparator, yazı geliştirmek için görünüşe göre iyot içeren kahverengi bir deniz yosunu kaynatma kullandı.
Başka bir gizli mürekkep tarifi, %10'luk bir sulu çözeltinin kullanılmasını içerir. sarı kan tuzu. Bu solüsyonla yazılan harfler kağıt kuruduğunda kaybolur. Yazıyı görmek için kağıdı %40 solüsyonla nemlendirmek gerekir. Demir klorür. Bu işlem sırasında görünen parlak mavi harfler artık kuruduğunda kaybolmaz. Harflerin görünümü, "turnbull blue" olarak bilinen karmaşık bir bileşiğin oluşumu ile ilişkilidir.
Fantomas'ın notunun kaybolma hikayesini hatırlıyor musunuz? Kaybolan mürekkep 50 ml karıştırılarak yapılabilir. alkol tentürü bir çay kaşığı ile iyot dekstrin ve çökeltiyi süzün. Bu tür mavi mürekkep, iyotun uçması nedeniyle 1-2 gün içinde tamamen rengini kaybeder.
Berthollet tuzunun sentezi
Unutulmaz deneyimleriniz için faydalıdır.
Ekipman: %50 potasyum hidroksit çözeltisi (KOH), potasyum permanganat (KMnO4), konsantre hidroklorik asit (yoğunluk = cm küp başına 1,19 g), nitrik asit,
gümüş nitrat çözeltisi (AgNO3), bir klor aparatı (geniş gaz çıkış borulu), bir beher, iki test tüpü, bir cam huni, bir filtre, bir demir sehpa, bir brülör. Deney bir davlumbazda veya açık havada gerçekleştirilir.
Klor elde etmek için cihazı monte edin. Potasyum permanganatı reaksiyon şişesine (1 cm tabaka) dökün, ekleme hunisini konsantre hidroklorik asitle doldurun ve şişeye yerleştirin (her şeyin hava geçirmez olduğundan emin olun). 30-40 ml %50 potasyum hidroksit çözeltisini bir behere dökün ve bir asbest ağı üzerinde neredeyse kaynama noktasına (70-80 derece) ısıtın. Potasyum permanganata hidroklorik asit ekleyerek dikkatlice (damla damla) klor elde edin (THROUGH!). Gaz çıkış borusundan düzgün bir yavaş klor akışı akmalıdır.
Baca borusunun ucunu sıcak bir kül suyu çözeltisine daldırın ve bir klor akımı çalıştırın. Zaten 5-6 dakika sonra. Berthollet tuzunun beyaz plastik kristalleri çözeltiden düşmeye başlayacaktır.
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O.
Klor iyonlarının saflaştırılması:
Çözeltinin soğumasını bekleyin, çökelen kristalleri süzün, filtre üzerindeki suyla yıkayın ve süzüntünün bir kısmını klorür iyonlarının varlığı açısından test edin. Bunu yapmak için süzüntüye biraz nitrik asit ve biraz gümüş nitrat ekleyin. Nitrik asitte çözünmeyen peynirli bir gümüş klorür çökeltisi düşerse, Cl iyonuna negatif bir reaksiyona kadar süzüntüyü yıkamaya devam edin.
piroforik demir sentezi
Ekipman: test tüpleri, huniler, filtre kağıdı, demir sülfat (FeSO4), amonyum oksalat.
Yangına neden olabileceğinden piroforik demiri saklamayın. Piroforik demir, eşmolar amonyum oksalat ve demir (II) sülfat veya Mohr tuzu çözeltilerinin dökülmesiyle hazırlanır. Çözeltileri hazırlamak için 20 g Mohr Tuzu alın ve 20 ml içinde çözün. su. 7.2 g miktarındaki amonyum oksalat da 20 ml içinde çözülür. su. Çözümleri birlikte dökün. Demir oksalat dihidrat (FeC2O4 * 2H2O) çökeltisi oluşacaktır. Çökeltiyi süzün ve amonyum tuzlarından iyice yıkayın.
Yıkanan çökeltiyi filtre kağıdı ile kurutun ve bir test tüpüne aktarın. Test tüpünü, delik hafifçe aşağı gelecek şekilde eğik olarak standa sabitleyin. Maddeyi brülörün alevinde dikkatlice ısıtın, filtre kağıdı ile göze çarpan su damlacıklarını çıkarın. Madde ayrışıp siyah toza dönüştüğünde tüpü kapatın. Yanıcı maddelerden uzak, güvenli bir yerde soğuması için piroforik demir içeren test tüpünü yerleştirin.
Bir demir veya asbest tabakasına döküldüğünde, piroforik demir alevlenir. Deneyim çok etkilidir.
Kendiliğinden yanma, çok ince bir ezilmiş, geniş yüzey oksidasyonu. Bu nedenle, deneyden sonra demir kalıntıları ortadan kaldırılmalıdır.
Şekerden kömür
30 g pudra şekeri tartın ve bir behere aktarın. ~12 ml konsantre sülfürik asidi pudra şekerine dökün. Şeker ve asidi bir cam çubukla duygusal bir kütleye karıştırın. Bir süre sonra karışım kararır ve ısınır ve çok geçmeden camdan gözenekli bir kömür kütlesi sürünmeye başlar.
sıvı içinde havai fişek
Dereceli silindire 50 ml etil alkol dökün. Silindirin dibine indirilen bir pipet aracılığıyla 40 ml konsantre sülfürik asit veriyoruz. Böylece, silindirde açıkça görülebilen bir sınır ile iki sıvı tabakası oluşur: üst tabaka alkol, alt tabaka sülfürik asittir.Silindire birkaç küçük potasyum permanganat kristali atıyoruz. Arayüze ulaştıktan sonra kristaller yanıp sönmeye başlar - burada havai fişeklerimiz var. Parlamaların ortaya çıkması, sülfürik asit ile temas halinde tuz kristallerinin yüzeyinde manganez anhidrit oluşması gerçeğinden kaynaklanmaktadır. Mn 2 O 7, az miktarda alkolü tutuşturan en güçlü oksitleyici ajandır:<
potasyum kromat çözeltisini H2S04 (turuncu renk) ile asitleştirin;<
kurşun nitrat ve potasyum iyodür (sarı);<
nikel(II) sülfat ve sodyum hidroksit ( yeşil renk);<
bakır (II) sülfat ve sodyum hidroksit (mavi);<
bakır (II) sülfat ve amonyak çözeltisi (mavi);<
kobalt(II) klorür ve potasyum tiyosiyanat (mor).<
- FeCl3 + 3KCNS® Fe(CNS) 3 + 3KCl
- 2K 2 CrO 4 + H 2 SO 4® K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
- Pb (NO 3) 2 + 2KJ® PbJ 2 + 2KNO 3
- NiSO4 + 2NaOH® Ni(OH)2 + Na2S04
- CuSO4 + 2NaOH® Cu(OH) 2 + 2Na2S04
- CuSO4 + 4NH3® 4
- CoCl2 + 2KCNS® Co(CNS) 2 + 2KCl
kimyasal yosun
Eşit hacimde su ile seyreltilmiş bir silikat yapıştırıcı çözeltisi (sodyum silikat) bir bardağa dökülür. Kalsiyum klorür, manganez (II), kobalt (II), nikel (II) ve diğer metallerin kristalleri camın dibine atılır. Bir süre sonra, karşılık gelen kristaller az çözünür alglere benzeyen silikatlar.
kimyasal saat
 Ekipman: 4 gr yiyecek sitrik asit, çakmaklar için iki çakmaktaşı (seryum bileşikleri (III ve IV içerir), 12 ml sülfürik asit (1: 2) çözeltisi, 1.7 g potasyum bromat KBrO3.
Ekipman: 4 gr yiyecek sitrik asit, çakmaklar için iki çakmaktaşı (seryum bileşikleri (III ve IV içerir), 12 ml sülfürik asit (1: 2) çözeltisi, 1.7 g potasyum bromat KBrO3.
2 çözelti hazırlayın. İlk durumda, iki hafif çakmaktaşı sülfürik asit içinde çözün. İkincisinde - 10 ml'de. Sitrik asidi sıcak suda eritin ve içine potasyum bromat dökün. Maddeleri tamamen çözmek için karışımı hafifçe ısıtın. Hazırlanan çözeltileri hızlıca bir araya dökün ve bir cam çubukla karıştırın. 20 saniye sonra açık sarı bir renk belirir. Değişiklikler koyu kahverengi ama 20 saniye sonra tekrar sarıya döner. 45 derecelik bir sıcaklıkta, böyle bir değişiklik 2 dakika içinde gözlemlenebilir. Daha sonra çözelti bulanıklaşır, karbon monoksit (IV) kabarcıkları öne çıkmaya başlar ve çözeltinin rengini değiştirme aralıkları kesin olarak tanımlanmış bir sırayla yavaş yavaş artar: sonraki her aralık bir öncekinden 10-15 saniye daha uzundur.
Başka bir tarif daha var: 2 g sitrik asidi 6 ml'de çözün. Odes'te 0,2 g potasyum bromat ve 0,7 ml ekleyin. konsantre H2SO4. Karışıma 10 ml hacme kadar su ekleyin, ardından 0.04 g potasyum permanganat (KMnO4) ekleyin ve tuz tamamen eriyene kadar iyice karıştırın. Çözeltinin renginde periyodik bir değişiklik var.
Kimyasal reaksiyonların mekanizması şu şekilde açıklanabilir: oksitleyici- onarıcı bromik asidin oksitleyici bir madde olarak ve sitrik asidin bir indirgeyici madde olarak işlev gördüğü bir işlem:
KBrO3 + H2SO4 = KHSO4 + HBrO3
9HBrO3 + 2C6H8O7 = 9HBrO + 8H2O + 12CO2
9HBrO + C6H8O7 = 9HBr + 4H2O + 6CO2
Çözeltinin rengindeki değişiklik, katalizörlerin etkisi altında meydana gelir - sırayla oksidasyon derecesini de değiştiren, ancak belirli bir iyon konsantrasyonuna kadar olan seryum ve manganez bileşikleri, bundan sonra ters işlem meydana gelir.
Bir şişede kimyasal vakum
Şişeyi karbon dioksit ile doldurun. İçine biraz konsantre çözelti dökün Heidelberg hidroksit Friedrich Wöhler Üniversitesi, amonyum tiyosiyanat NH 4 NCS ve cıva nitrat Hg (NO 3 ) 2'nin sulu çözeltilerini karıştırarak, çözeltiden beyaz bir çökeltinin çökeldiğini buldu. Wöhler çözeltiyi süzdü ve ortaya çıkan cıva tiyosiyanat Hg (NCS) 2 çökeltisini kuruttu ve sonra meraktan onu ateşe verdi. Tortu alev aldı ve bir mucize oldu: belirsiz beyaz bir yumrudan kıvrılarak, sürünerek dışarı çıktı ve uzun siyah-sarı bir "yılan" büyüdü. Ateşlemeden sonra cıva tiyosiyanat hızla siyah cıva sülfür HgS, sarı hacimli karbon nitrür C3N4, karbon dioksit ve kükürt dioksit oluşturmak üzere ayrışır. Hızla kaçan gazlar, katı reaksiyon ürünlerinden oluşan bir yılanı "sürünmeye" zorlar. Usta ellerde 1 gr amonyum tiyosiyanat ve 2.5 gr cıva nitrattan 20-30 cm uzunluğunda bir yılanın elde edilmesi şaşırtıcıdır, ancak cıva tuzları zehirlidir ve bunlarla uğraşmak özen ve dikkat gerektirir. İki renkli bir yılanı göstermek daha güvenlidir.
dikromat yılan
Karıştırın ve ardından bir havanda öğütün 10 g potasyum dikromat K 2 Cr 2 O 7, 5 gr potasyum nitrat KNO 3 ve 10 gr Sahra. Elde edilen toz, etil alkol ve kolodion ile nemlendirilir ve 4-5 mm çapında bir cam tüpe preslenir. Ateşlendiğinde, önce siyah, sonra da tiyosiyanat gibi sürünen ve kıvrılan yeşil bir yılan oluşturan karışımın bir "çubuğu" ortaya çıkıyor: saniyede 2 mm hızla yanar ve 10 kat uzar. ! Sükrozun iki oksitleyici ajan, potasyum nitrat ve potasyum dikromat varlığında yanma reaksiyonu oldukça karmaşıktır; sonuçta siyah kurum parçacıkları, yeşil krom oksit, bir potasyum karbonat eriyiği ve ayrıca karbon dioksit ve azot oluşturdu. Gazlar katı karışımı şişirir ve hareket etmesine neden olur.
Bir dikromat yılanı yapmak için başka bir tarif, 1 g tozların karıştırılmasını içerir. amonyum dikromat(NH 4) 2 Cr 2 O 7, 2 gr amonyum nitrat NH 4 NO 3 ve 1 gr pudra şekeri. Bu karışım suyla nemlendirilir, bir çubuk şeklinde kalıplanır ve havada kurutulur. Asa ateşe verilirse, siyah-yeşil yılanlar farklı yönlerde sürünerek çıkar. Buradaki reaksiyon ürünleri, önceki tariftekiyle aynıdır.
nitrat solucanı
3-4 yemek kaşığı elenmiş nehir kumu bir yemek tabağına dökülür, üstünden girintili bir tepe yapılır ve 1/2 çay kaşığından oluşan bir reaksiyon karışımı hazırlanır. amonyum nitrat ve 1/2 çay kaşığı toz şeker, dikkatlice havanda öğütün. Daha sonra lamın girintisine 1/2 yemek kaşığı daha dökülür. etil alkol ve 1 çay kaşığı pişmiş dökün nitrat-şeker karışımlar. Bundan sonra, sadece alkole ateş yakmak için kalır. Hemen, karışımın yüzeyinde siyah kömürleşmiş şeker topları belirir ve onlardan sonra tepeden aşağı siyah, parlak ve kalın bir "solucan" büyür. Eğer bir nitrat-şeker karışım 1 çay kaşığından fazla alınmadı, daha sonra solucanın uzunluğu 3-4 cm'yi geçmeyecek ve kalınlığı slaydın girintisinin çapına bağlı.
Alkol ve glukonat yılanları
bunlar en çok basit tarifler kimyasal serpantariumumuzdan. eğer bir hap sert alkol(kuru yakıt) konsantre sulu çözelti ile emprenye edin amonyum nitrat, bir pipetten damlatın ve ardından kurutun, sonra üç veya dört kez bu işlemleri tekrarlayarak ruh yılanı için hammadde elde edebilirsiniz. Ateşlenen tablet şişer; yılanın rengi siyahtır. Katı alkolün bir parçası olan ürotropin (CH 2 ) 6 N 4'ün amonyum nitrat ile karıştırılması karbon, karbondioksit, nitrojen ve su oluşumuna yol açar.
Bir glukonat yılanı elde etmek için aleve bir hap getirmeniz yeterlidir. glukonat kalsiyum, her eczanede satılan. Hacmi orijinal maddenin hacmini çok aşan tabletten bir yılan sürünecek. Ca2 bileşimine sahip kalsiyum glukonatın ayrışması. H 2 O, kalsiyum oksit, karbon, karbon dioksit ve su oluşumuna yol açar.
çırpma şeritleri
Ekipman: filtre kağıdı, alkol iyot çözeltisi, %25 amonyak çözeltisi, cam çubuk, kalay (kontrplak), cam.
Filtre kağıdını iyot ve amonyak çözeltisi (1:1) karışımı olan bir bardağa koyun. Islak kağıdı ince şeritler halinde kesin ve kuruması için bir kalıba koyun, yaklaşık bir gün kururlar. Bir cam çubuk tehlikeli şeritlere dokunduğunda, bir patlama meydana gelir, bir atış.
Burada saf nitrojen iyodür oluşmaz, ancak amonyak NI3*NH3 ile moleküler bileşiği oluşur. Nitrojen iyodürde, nitrojenin oksidasyon durumu -3 ve iyodin +1'dir. İyotun pozitif oksidasyon durumu, nitrojen ile çok zayıf bir bağ oluşturur. Madde termodinamik olarak kararsız, bu nedenle patlama sırasında iyot buharı ve serbest azot oluşumu ile ayrışır:
Bu aynı zamanda bir karışımdır!
Amalgam oluşumunun birçok metalde bulunan bir özellik olduğu bilinmektedir. Ancak bu sefer amalgamdan bahsedeceğiz... amonyum!
Konsantre sulu bir amonyum klorür NH4Cl çözeltisi, yüksekliğinin yarısına kadar büyük bir porselen plaka üzerine yerleştirilmiş bir cam silindire dökülür. Çözeltiye 10-15 g sıvı sodyum amalgam (Na, Hg) eklenir.Hemen, çok kararsız bir madde olan amonyum amalgam oluşumunun kimyasal reaksiyonu hızla cıva Hg, amonyak NH ve hidrojen H2'ye ayrışır. . Serbest kalan hidrojen amalgamı şişirir ve süngerimsi kütle gri renk yavaşça silindirden plakanın üzerine sürünür. Bu muhteşem gösteri iki tepkiyle ilişkilidir:
(Na, Hg) + NH4 Cl\u003d (NH 4+, Hg -) + NaCl
2(NH4+, Hg -) = 2NH3 + 2Hg + H2
İlk reaksiyonda amonyum amalgamı oluşur ve ikincisinde ayrışır. Sodyum amalgamdaki (Na , Hg ) cıva atomu Hg'nin sodyum atomu Na'dan bir elektron "aldığı" bulundu (bu, sodyum cıvanın oluştuğu anlamına gelir). Ve karşılık gelen amalgamdaki amonyum katyonu, pozitif yüküyle ayrılmaz; görünüşe göre, bu aynı zamanda kimyasal bir bileşiktir - amonyum cıva.
Herkes gökkuşağını sever - hem çocuklar hem de yetişkinler. Renkli tonları göz alıcıdır, ancak değeri yalnızca estetikle sınırlı değildir: aynı zamanda harika yolçocuğu bilime ilgilendirmek ve dünya bilgisini heyecan verici bir oyuna dönüştürmek için! Bunu yapmak için, ebeveynlerin çocuklarıyla birkaç deney yapmasını ve evde gerçek bir gökkuşağı elde etmesini öneriyoruz.
Newton'un izinde
1672'de Isaac Newton, sıradan beyazın farklı renkteki ışınların bir karışımı olduğunu kanıtladı. "Odamı kararttım," diye yazdı, "güneş ışığının içeri girmesi için panjurda çok küçük bir delik açtım." Güneş ışını yolunda, bilim adamı özel bir üçgen cam - bir prizma yerleştirdi. Karşı duvarda, daha sonra spektrum adını verdiği çok renkli bir şerit gördü. Newton bunu, prizmanın beyaz ışığı bileşen renklerine ayrıştırdığını söyleyerek açıkladı. Sonra çok renkli bir ışının yoluna başka bir prizma yerleştirdi. Bununla bilim adamı, tüm renkleri sıradan bir güneş ışını halinde yeniden bir araya getirdi.
Bir bilim insanının deneyini tekrarlamak için mutlaka bir prizmaya ihtiyaç yoktur - elinizde olanı kullanabilirsiniz. Güzel havalarda, odanın güneşli tarafındaki bir pencerenin yanındaki masanın üzerine bir bardak su koyun. Güneş ışınlarının üzerine düşmesi için pencerenin yanına yere düz bir kağıt yerleştirin. Pencereyi sıcak suyla ıslatın. Ardından, kağıt üzerinde küçük bir gökkuşağı oynayana kadar camın ve kağıdın konumunu değiştirin.
Aynanın içinden gökkuşağı
Deney hem güneşli havalarda hem de bulutlu havalarda yapılabilir. Sığ bir su kabı, küçük bir ayna, bir el feneri (pencerenin dışında güneş yoksa) ve bir beyaz kağıt gerektirir. Aynayı suya daldırın ve kasenin kendisini güneş ışınları üzerine düşecek şekilde yerleştirin (veya bir el fenerinin ışınını aynaya doğrultun). Gerekirse, nesnelerin eğim açısını değiştirin. Suda, ışık kırılmalı ve renklere ayrılmalıdır, böylece bir beyaz kağıt yaprağı küçük bir gökkuşağını "yakalayabilir".
kimyasal gökkuşağı
Sabun köpüğünün gökkuşağı renginde olduğunu herkes bilir. Bir sabun köpüğünün duvarlarının kalınlığı, homojen olmayan bir şekilde değişir, sürekli hareket eder, bu nedenle rengi sürekli değişir. Örneğin, 230 nm kalınlığında kabarcık turuncuya, 200 nm'de yeşile ve 170 nm'de maviye döner. Suyun buharlaşması nedeniyle, sabun köpüğünün duvarının kalınlığı görünür ışığın dalga boyundan daha az olduğunda, kabarcık gökkuşağı renkleriyle parlamayı keser ve patlamadan önce neredeyse görünmez hale gelir - bu yaklaşık bir duvar kalınlığında meydana gelir. 20-30 nm.
Aynı şey benzinde de oluyor. Bu madde suyla karışmaz, bu nedenle yolda bir su birikintisi içindeyken yüzeyine yayılır ve güzel yanardöner lekeler oluşturan ince bir film oluşturur. Bu mucizeyi sözde girişime - ya da daha basit olarak, ışığın kırılmasının etkisine borçluyuz.
müzikal gökkuşağı
Girişim, CD'lerin yüzeyinde yanardöner taşmalara neden olur. Bu arada, bu en çok basit yollar Evde gökkuşağının "üretimi". Güneşin yokluğunda uygun ve masa lambası ve bir el feneri, ancak bu durumda gökkuşağı daha az parlaktır. Sadece CD'nin açısını değiştirerek, bir duvarda veya başka herhangi bir yüzeyde bir gökkuşağı şeridi, dairesel bir gökkuşağı ve huzursuz gökkuşağı tavşanları elde edebilirsiniz.
Ayrıca, neden bir çocuğa müzik okuryazarlığının temellerini öğretmiyorsunuz? Sonuçta, Newton başlangıçta gökkuşağında sadece beş renk (kırmızı, sarı, yeşil, mavi ve mor) ayırt etti, ancak daha sonra iki tane daha ekledi - turuncu ve mor. Böylece bilim adamı, spektrumdaki renk sayısı ile müzikal ölçekteki nota sayısı arasında bir yazışma oluşturmak istedi.
Projektör-gece lambası
Geçici bir çözüm sizin için yeterli değilse, örneğin, böyle bir minyatür projektör kullanarak evde “hiç” bir gökkuşağı başlatabilirsiniz. Duvarlara ve tavana bir gökkuşağı yansıtır - geceleri, hatta bulutlu bir günde, canlandırıcı renklerin çok eksik olduğu zamanlarda bile... Projektör iki modda çalışabilir: tüm renkler birlikte veya ayrı ayrı. Yeni Yıl tatillerinin arifesinde, bu belki bir çocuk veya sadece yaratıcı bir kişi için iyi bir hediye fikridir.
pencere askısı
"Endişesiz gökkuşağının" başka bir versiyonu (ancak sadece gündüz saatlerinde ve sadece güneşli havalarda kullanılabilir), modern lazer teknolojisi kullanılarak yapılan sözde gökkuşağı diskidir. 10 cm çapında bir cam prizma, krom plastik bir kasanın içine yerleştirilmiştir. Vantuz ile pencereye takılır ve güneş ışığını dönüştürerek odanın duvarlarına, zeminine ve tavanına yansıtır. Toplamda 48 renk çizgisi vardır: kırmızı, turuncu, sarı, yeşil, mavi, çivit mavisi, menekşe ve aradaki tüm tonlar.
3D efektli kitap çevirin
Son birkaç yılda, ilginç ve sıra dışı etkileri olan kitaplar ortaya çıkmaya başladı - örneğin, akan resimlerle "flipbooklar". Birçoğumuz bu teknolojiye kendi çocukluğumuzdan aşinayız: Bir defterin kenarlarına resimler çizdik ve sonra sayfaları hızlıca çevirerek onları canlandırdık. Bu eğlencenin ilkesine ilişkin kitap, Japon tasarımcı Masashi Kawamura tarafından yaratıldı. Hızlıca kaydırırsanız, üç boyutlu bir gökkuşağı görebilirsiniz!
İstenirse, kendi ellerinizle benzer bir manuel gökkuşağı yapılabilir ve aynı zamanda çocuğa animasyon efektini açıkça gösterebilirsiniz. Bunu yapmak için, kağıda yazdırın veya defterin her sayfasına gökkuşağı renklerinden kareler çizin. Toplamda 30-40 sayfaya ihtiyaç vardır. Her sayfanın bir tarafında onları normal sırayla ve diğerinde - ters sırada çizmeniz gerektiğini akılda tutmak önemlidir, aksi takdirde gökkuşağında başarılı olamazsınız.
Dokunabileceğin bir gökkuşağı
Ve herhangi biri için harika bir dekorasyon olacak bir gökkuşağı elde etmenin başka bir eğlenceli yolu modern iç mekan, tek bir santimetre boşluk almadan ve yanardöner parlaklıkla doldurmadan. Bunu yapmak için Meksikalı tasarımcı Gabriel Dawe, ustaca gerilmiş dikiş ipliklerinin kullanılmasını önerir. Böyle bir kurulumla elbette bir veya iki saat uğraşmanız gerekecek, ancak sonuç buna değer. Sanatçının çalışmalarının ABD, Belçika, Kanada ve İngiltere dahil olmak üzere birçok ülkede büyük bir başarı elde etmesi boşuna değil.
Talimat
Newton'un kurduğu gibi, farklı renkteki ışınların etkileşimi sonucunda beyaz bir ışık demeti elde edilir: kırmızı, turuncu, sarı, yeşil, mavi, çivit mavisi, menekşe. Her renk belirli bir dalga boyu ve titreşim frekansı ile karakterize edilir. Saydam ortamın sınırında ışık dalgalarının hızı ve uzunluğu değişir, salınım frekansı aynı kalır. Her rengin kendi kırılma indisi vardır. Kırmızı ışın önceki yönden en az sapar, turuncu biraz daha fazla, sonra sarı vb. Mor ışın en yüksek kırılma indisine sahiptir. Bir ışık demetinin yoluna bir cam prizma takılırsa, yalnızca sapmakla kalmaz, aynı zamanda farklı renklerde birkaç ışına da bölünür.
Ay ile sıklıkla karıştırılan başka bir fenomen daha vardır - bulut kristallerinden geçen ışığın kırılması nedeniyle oluşan ay diskinin etrafında bir hale, çok renkli veya halka.
Bibliyografik açıklama: Matveeva E.V., Mardanova R.Z., Matveeva L.I. Kimyasal gökkuşağı // Genç bilim adamı. 2018. №3. S.87-91..05.2019).
alaka
Çevremizde çeşitli renklerde bileşikler ve maddeler vardır, bunlar arasında doğadaki en ilginç fenomen gökyüzünde beliren gökkuşağıdır. Maddeler neden farklı renklere sahiptir ve bazı bileşikler bukalemunlar gibi renklerini değiştirir? Renk değiştirebilen bir bukalemun malzemesi elde etmek mümkün müdür? Bu, nanoteknoloji alanındaki yeni gelişmelerin gelişimi ışığında önemlidir.
Hedef:Özellikleri Keşfedin inorganik maddeler-bukalemunlar.
Görevler:
- Belirli bir renge sahip bileşikler hakkında bilgi edinin.
- Farklı renkteki bileşiklerin uygulama alanlarını öğrenin.
- Çeşitli bileşiklerin rengini hangi faktörlerin belirlediğini belirleyin.
- Uygun reaktifleri seçin ve sırayla çalıştırın kimyasal reaksiyonlar bir şişedeki çözeltinin renginde gökkuşağının renklerine bir değişiklik ile.
- Bukalemun malzemesini almaya çalışın.
Çalışma hipotezi. Belki de, kimyasal reaksiyonların bir sonucu olarak krom, vanadyum, manganez ve bakır bileşikleri içeren reaktifler kullanarak, test tüpündeki çözeltinin renginin renk sırasına göre değişeceği bir dizi dönüşüm gerçekleştirin. gökkuşağı.
Yenilik Pratik bir şekilde, gökkuşağının renkleri sırasına göre bir şişede bir dizi kimyasal reaksiyon gerçekleştirildi. Bukalemun malzemesi elde etme girişimi.
Çalışmanın amacı. D-elementlerinin bileşikleri: manganez, krom ve vanadyum.
Son teslim tarihleri vearaştırma yeri.Çalışmalar, 2017–18 yıllarında Neftekamsk'taki MOAU "Lyceum No. 1" laboratuvarında gerçekleştirildi.
Araştırma Yöntemleri: arama ve araştırma, gözlem, karşılaştırma, deney.
pratik kısım
deney 1test tüpleri., , , , .
Farklı test tüplerinde gökkuşağı renkleri elde etmek için aşağıdaki solüsyonları 7 test tüpüne çiftler halinde dökün:
1. test tüpünde demir (III) klorür ve potasyum tiyosiyanat (kırmızı renk):
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl
2. test tüpünde: potasyum kromat çözeltisini H2S04 (turuncu) ile asitleştirin:
2K 2 CrO 4 + H 2 SO 4 \u003d K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
3. test tüpünde: kurşun nitrat ve potasyum iyodür (sarı)
Pb(NO3) 2 + 2KI = PbI 2 + 2KNO 3
4. test tüpünde: nikel(II) sülfat ve sodyum hidroksit (yeşil);
NiSO 4 + 2NaOH \u003d Ni (OH) 2 + Na2S04
5. test tüpünde: bakır (II) sülfat ve sodyum hidroksit (mavi);
CuSO 4 + 2NaOH \u003d Cu (OH) 2 + 2Na 2 SO 4
6. tüpte: bakır (II) sülfat ve amonyak çözeltisi (mavi renk);
CuSO 4 + 4NH3 \u003d SO4
6. tüpte: kobalt(II) klorür ve potasyum tiyosiyanat (mor)
CoCl 2 + 2KCNS = Co(CNS) 2 + 2KCl


Deney 2. Gökkuşağı 1. şişede., , , , , , , .
Bir şişede, çözeltinin renginin bir dizi gökkuşağı renginde değiştiği reaksiyonlar gerçekleştirildi.
1) Kırmızı olmak. Kimyasal bir şişeye az miktarda krom (VI) oksit kristalleri ve su ilave edildi: CrO 3 + H 2 O \u003d H 2 CrO 4
Reaksiyon sonucunda kırmızı renkli kromik asit H 2 CrO 4 elde edilmiştir.
2) Fiş turuncu renk. Daha sonra aynı şişeye ayrıca CrO 3 kristalleri ilave edildi: H2CrO 4 + CrO3 \u003d H2Cr207 turuncu dikromik asit
3) Sarı almak. Elde edilen dikromik aside fazla miktarda alkali NaOH çözeltisi ilave edildi:
H2Cr207 + 4NaOH (örn.) = 2Na2CrO4 + 3H20 sarı sodyum kromat aldı.
4) Yeşil almak. Daha sonra şişeye hidrosülfid asit ilave edildi. Reaksiyonun bir sonucu olarak, çözeltinin yeşil hale gelmesi nedeniyle yeşil bir Cr(OH) 3 çökeltisi elde edilir. 2Na 2 CrO 4 + 3H 2 S + 2H 2 O \u003d 2Cr (OH) 3 ↓ + 3S + 4NaOH
5) Fiş Mavi renk . Şişemize bakır sülfat eklenirse, çözeltide bulunan sodyum hidroksit onunla reaksiyona girer.
2NaOH + CuSO 4 \u003d Cu (OH) 2 ↓ + Na 2 SO 4
Reaksiyon sonucunda mavi bir Cu (OH) 2 çökeltisi elde edilmelidir, ancak çözeltide yeşil Cr (OH) 3 bulunduğundan çözelti mavi olur.
CuSO 4 (örn.) + 4NH40H \u003d SO 4 + 4H20
Mavi bir bakır (II) tetraamin sülfat S04 çözeltisi elde edilecektir.
7) Fiş mor . Mor bir çözelti elde etmek için, fazla bakır sülfat ile reaksiyona girecek olan çözeltimize potasyum permanganat eklemek gerekir. CuSO 4 + 2KMnO 4 \u003d Cu (MnO 4) 2 + K 2 SO 4
Gökkuşağımızın son rengi olan mor bir renge sahip bir bakır permanganat Cu (MnO 4) 2 çözümümüz var.







deney 3"VO'nun artımlı kurtarma3 ─ V'ye2+ metal çinkoasidik ortam", , ,
0.25 g'lık bir şişeye yerleştirildi. amonyum vanadat NH4VO3 ve %20 hidroklorik asit solüsyonu eklendi. Berrak sarı bir çözelti elde edildi. Elde edilen çözeltiye 6-7 çinko granülü eklendiğinde, atomik H2 salınır, bu da vanadyum V'yi ara aşamalar yoluyla kademeli olarak valans II'ye düşürür. Çözelti yavaş yavaş rengi mavi, yeşil ve mor olarak değiştirir.
İlk olarak, amonyum metavanadat vanadil klorür VOCl 2'ye indirgenir.
mavi: 2 NH4VO3 + Zn + 8HCl = 2VOCl2 + ZnCl2 + 2NH4Cl + 4H2O
Daha sonra vanadil klorür vanadyum (III) klorür VCl 3 yeşile indirgenir:
2VOCl2 + Zn + 4HCl = 2VCl3 + ZnCl2 + 2H2O
Ve son olarak, vanadyum (III) klorür vanadyum (II) klorüre indirgenir, mor: 2VCl3 + Zn = 2VCl2 + ZnCl2
Vanadyum V +5'in indirgeme reaksiyonları, karakteristik bir renge sahip ara iyonların oluşumu ile adım adım ilerler: +5 (sarı), +4 (mavi), +3 (yeşil), +2 (mor).




deney 4"Kimyasal Bukalemun"(ortamın pH'ına bağlı olarak) , , , .
Üç behere koyu kırmızı bir potasyum permanganat çözeltisi döküldü. İlk silindire biraz seyreltik hidroklorik asit, ikinci silindire su ve üçüncü silindire de sodyum hidroksit çözeltisi döktüler. Daha sonra tüm beherlere sodyum sülfit ilave edildi ve bir cam çubukla iyice karıştırıldı. İlk silindirde, çözelti anında renksizleşir, ikincisinde renk bozulmasıyla birlikte kahverengi bir topaklanma çökeltisi düşer ve üçüncüde koyu kırmızı renk parlak yeşile dönüşür. Karşılaştırma için yanlarına ahududu potasyum permanganat çözeltisi de koyabilirsiniz.
Bu deneyler, potasyum permanganatın çeşitli ortamlarda nasıl davrandığını göstermektedir.
Böylece asidik bir ortamda Mn2 + iyonuna (renksiz çözelti) indirgenir:
2KMnO4 + 5Na2SO3 + 6HCl = 2MnCl 2 + 3H2O + 5Na 2SO4 + 2KCl
Nötr bir ortamda, indirgeme manganez (IV) okside (kahverengi çökelti) gider:
2KMnO4 + 3 Na 2SO3 + H2O \u003d 2MnO2 ↓ + 2KOH + 3 Na 2SO4
Güçlü alkali bir ortamda MnO42- iyonları oluşur (yeşil renk)
2KMnO4 + Na 2SO3 + 2NaOH \u003d 2 Na2MnO4 + K 2SO4 + H2O



deney 5Bukalemun malzemesi elde etmeye çalışmak
Her yüzeyin kimyasal bileşimi benzersiz olduğundan, farklı dalga boylarındaki ışığı emer. Yüzeyin rengini değiştirmek, kimyasal bileşim. Ancak karbonun (grafen) nanoyapısına krom atomlarını ve iyonlarını dahil etmeye çalışırsanız, hemen hemen tüm renkleri alabilen, rengini değiştirecek bir bukalemun malzemesi elde edebilirsiniz. O zaman böyle bir malzeme bir "görünmezlik pelerini" olarak kullanılabilir.
Tabii ki, böyle bir materyali elde etmek için özel teçhizat. Ama biz böyle bir malzeme elde etmeye çalıştık. aktif karbon, krom bileşikleri ve silikon esaslıdır.
1 seçenek . Karbon ve krom bileşiklerine dayalı bir malzeme aldı. Bunun için kömür bir havanda ezildi, daha sonra krom bileşikleri ile karıştırıldı, refrakter bir yüzeye mümkün olduğunca ince bir şekilde yayıldı ve ısıtıldı. Sonuç, koyu rengin heterojen bir karışımıydı.
Seçenek 2. Silikon ve krom bileşiklerine dayalı bir malzeme yapılmıştır. Bunu yapmak için silikon eritildi ve bir harç içinde krom bileşikleri karışımı ile öğütüldü. Soğuduktan sonra malzeme harçtan oldukça iyi ayrılır. Ortaya çıkan malzeme hala oldukça kalın. Mikroskop altında, çok renkli krom bileşiklerinin ayrı kristalleri görülebilir. Işıkta, malzeme ışığı iyi yansıtır, ancak çeşitli renklerin renkleri henüz çok belirgin değildir. İşte elimizdekiler:



Tabii ki, bunlar şimdiye kadar sadece hipotezler ve deneme deneyleri, sürecin daha fazla araştırılması gerekiyor ve malzeme elde etmek için oldukça zahmetli ve özenli bir çalışma yapılması gerekiyor.
8) Araştırma sonuçları
- ile bileşiklerin özellikleri renkler gökkuşakları ve bukalemun maddeler , , , , , .
- Krom, manganez ve vanadyum bileşiklerinin uygulama alanlarını öğrendik. Boyamada, analitik kimyada kalite ve kaliteyi belirlemek için çeşitli renklerde kimyasal bileşikler kullanılır. nicel kompozisyon maddeler, tekstil, cam, boya ve vernik sanayi vb. , , , .
- Çeşitli bileşiklerin renginin şunlara bağlı olduğunu öğrendik:
1) ışığın madde molekülleri ile etkileşiminden;
2) organik maddelerde, elementin elektronlarının uyarılması ve diğer seviyelere geçişinin bir sonucu olarak renk ortaya çıkar, tüm büyük molekülün elektron sisteminin durumu önemlidir;
3) inorganik maddelerde, renk elektronik geçişlerden ve bir elementin atomundan diğerinin atomuna yük transferinden kaynaklanır, elementin dış elektron kabuğu tarafından önemli bir rol oynar;
4) bileşiğin rengi dış ortamdan etkilenir;
5) Bileşikteki elektron sayısı önemli bir rol oynar.
- Uygun reaktifleri seçtik ve gökkuşağının renkleri sırasına göre bir şişede çözeltinin renginde bir değişiklik ile ardışık kimyasal reaksiyonlar gerçekleştirdik.
- Kromlu silikon ve silikonlu karbon bileşikleri esaslı bir bukalemun malzemesi elde etmeye çalıştık.
Çözüm
Madde-bukalemunların özelliklerini araştırdı.
Kimyasal reaksiyonlar sonucunda gökkuşağının çeşitli renklerinde bileşikler oluşturabilen maddeler arasında d-elementleri bulunur: krom, vanadyum.
Manganez, krom ve vanadyum, farklı oksidasyon durumlarına girerken renk değiştirebilen "kimyasal bukalemunlardır".
Araştırma umutları. Krom, bakır ve manganez elementlerinin bileşiklerinin özelliklerinin daha fazla incelenmesi.
Gelecekte, nanoteknoloji alanındaki en son gelişmeleri kullanarak krom ve karbon (veya silikon) bazlı, bir kişinin isteği üzerine renk değiştirebilen, muhtemelen sinir uyarıları ile düzenlenen böyle bir bukalemun materyali oluşturmak. O zaman "görünmezlik pelerini" gibi bir malzeme ya da en azından kamuflaj işlevi görebilecek bir malzeme yaratmak bile mümkün olabilir.
pratik önemi. Kimya derslerinde edinilen bilgileri "OVR", "d-elemanları" vb. konuları işlerken kullanmak, derslerde deneyler yapmak ve müfredat dışı etkinlikler; maddelerin kalitatif ve kantitatif analizi sırasında analitik kimyada uygulama; [resimlerin restorasyonu sırasında.
Edebiyat:
- Analitik Kimya. Nitel analiz. G. M. Zharkova, E. E. Petukhova, St. Petersburg "Kimya", 1993. (s. 235–236).
- Artemenko A. I. "Organik kimya ve insan" ( teorik temel, ileri düzey kurs). Moskova, "Aydınlanma", 2000.
- Kiplik D. I. Boyama tekniği - M.: SVAROG ve K, 1998.
- Metodik geliştirme"Vanadyum. niyobyum. Tantal". / Komp. Yu.E. Elliev, Yu.B. Zverev, S.G. Chesnokova. - N.Novgorod
- İnorganik kimya, L. G. Baletskaya, Rostov-on-Don, "Phoenix", 2010 (s. 272–288).
- Niteliksel kimyasal yarı mikroanaliz atölyesi. M. V. Mikhaleva, B. V. Martynenko, M.: Bustard, 2007. (s. 72-75).
- Fadeev G. N. "Kimya ve Renk" (ders dışı okuma için bir kitap). Moskova, Aydınlanma, 1977
- Renk değiştiren bukalemun malzemesi NanoNewsNet.ru› news/2015/material-khameleon-…
- Bilim ve yaşam. Kimyaya dikkat edin. V.V. Ryumin'in kitaplarından https://www.nkj.ru/archive.
- Gökkuşağında kaç renk var? Gökkuşağında hangi renkler var http://fb.ru/article.
- Usova Nadezhda Terentyevna belediye Eğitim kurumu Tomsk'taki 24 numaralı spor salonu. Usova Nadezhda Terentyevna kimyasal bukalemunlar. Metodik geliştirme Tomsk 2006. Usova2.pdf
- Krom ve bileşikleri ile kimyasal deneyler kristallikov.net
- Meraklılar için Kimya | Krom alhimik.ru ile renkli çökeltiler
- Reaksiyon denklemlerinde kimya. Zh. A. Kochkarov, Rostov-on-Don, "Phoenix", 2017, (s. 182–211, 226–229, 213–223).
- Krom ve bileşikleri https://www.tutoronline.ru/blog/hrom-i-ego-connectionenij.
saatte üç inç sabit bir oranda yandı. Kalan parçanın uzunluğunu ölçerek, bu tür saatlerin başlangıcından bu yana ne kadar zaman geçtiğini oldukça doğru bir şekilde belirlemek mümkün oldu.
Çift sarmal... Bu görüntüde şaşırtıcı derecede tanıdık bir şey vardı. Ama ne? Eh, elbette, DNA molekülü çift sarmal şeklindedir.Doğru, iplerin sarmalı birkaç saat içinde yanarken, DNA sarmalı hücrenin ömrü boyunca kendini kopyalamaya devam eder...
Eret, tahminini doğrulayabileceği deneyler yaparak canlı bir organizma aramaya başladı. Seçim infusoria ayakkabısına düştü - basit tek hücreli organizma. Ehret, "Genellikle siliatlar gündüzleri geceden daha aktiftir," diye mantık yürüttü. "DNA molekülüne etki ederek onun yaşam ritmini bozmak mümkünse, bu molekülün biyolojik saat mekanizması olarak da görev yaptığı kanıtlanmış sayılabilir."
Bir etki aracı olarak bir ışık demeti seçti. Bir dizi deneyden sonra, ayakkabı üzerinde dönüşümlü olarak ultraviyole radyasyon ve beyaz ışıkla hareket ederek, kişinin ya siliatın yaşam ritmini büyük ölçüde değiştirebileceğini ya da tekrar eski haline getirebileceğini bulmayı başardı.
Ehret, "Ultraviyole DNA sarmalına zarar verir, ancak hücre bir ultraviyole darbesinden sonra (beyaz ışıkla maruz kalırsa) hasarı onarabilir" dedi.
Kısa bir süre sonra, Ehret'in sonuçları, DNA molekülü üzerinde çeşitli kimyasallarla hareket eden diğer bilim adamları tarafından doğrulandı.
özü buna bağlı olan riyu.
Bu durumda Amerikalı bilim adamının "chronon" olarak adlandırdığı DNA molekülü, hücre çekirdeğinde sıkı bir spiral halinde sarılır. Molekülün kopyalanması başladığında, böyle bir sarmalın iplikleri birbirinden ayrılır ve üzerlerine bilgi RNA'sı inşa edilir, tek bir DNA zincirinin tam uzunluğuna ulaşır - "kroion". Aynı zamanda, oranlarının oranı, saatin düzenleyici mekanizmasının işi olarak kabul edilebilecek, birbiriyle ilişkili bir dizi kimyasal reaksiyon meydana gelir.
Eret, modelini "tüm detayların atlandığı bir iskelet ..." olarak değerlendirdi. Ancak bu ayrıntılarda, görünüşe göre, biyolojik saatin temellerinin temeli gizlidir. DNA replikasyonu sırasında hangi kimyasal reaksiyonlar gerçekleşir?
TEST TÜPÜNDE "RAINBOW"
Yirmi yıl önce, Sovyet bilim adamı B.P. Belousov, yeni bir tür titreşimli redoks reaksiyonu keşfetti. Test tüpündeki sıvı gözümüzün önünde rengini değiştirdi: Bir zamanlar kırmızıydı, şimdi maviydi, sonra tekrar kırmızıya döndü... Renk değişimi kesinlikle periyodik olarak devam etti.
Belousov, sempozyumlardan birinde gözlemlediği fenomenden bahsetti. Mesaj büyük bir ilgiyle dinlendi, ancak yazarın kendisi de dahil olmak üzere hiç kimse, titreşimli reaksiyonların ilk bileşenlerinin, bileşimde canlı bir hücrenin maddelerine, DNA maddelerine çok benzeyen organik maddeler olduğu gerçeğine fazla önem vermedi. . Sadece 1960'da başka bir Sovyet