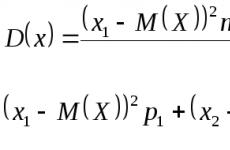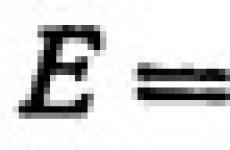Какво се нарича скорост на химическа реакция в какво. Каква е константата на скоростта на химична реакция? Фактори, влияещи върху скоростта на реакцията
Всички движения са непрекъсната верига
форма И възникват един от
друг в известен ред.
Лукреций
Какво е механизъм химическа реакция? Какво е кинетичното уравнение на реакцията и какъв е смисълът му? Какъв е механизмът на действие на катализатора? Какво представляват инхибиторите?
Урок-лекция
ХИМИЧНА РЕАКЦИЯ КАТО ПРИМЕР ЗА ДВИЖЕНИЕ. Спомнете си каква е скоростта на химичната реакция и от какви фактори зависи тя.
Химичните реакции протичат с различна скорост. Диапазонът на техните скорости е изключително широк - от почти мигновени реакции (експлозия, множество реакции в разтвори) до изключително бавни, които отнемат векове (например окисляването на бронза във въздуха).
Гравиране. Алхимици
През 19 век беше установено, че по-голямата част от химичните реакции са многоетапни процеси, т.е. те не се извършват чрез директен едновременен сблъсък на частици на реагентите с образуването на продукти, а чрез серия от прости (елементарни) процеси. Наистина, ако например реакцията на окисляване на амоняка протича в един етап, тогава това ще изисква огромни енергийни разходи за едновременното разрушаване на връзките в молекулите на амоняка и кислорода. Освен това вероятността от сблъсък на три частици е много малка, четири - почти равна на нула. Едновременният сблъсък на седем частици (четири молекули амоняк и три молекули кислород) е просто невъзможен.
Всеки елементарен етап от химическа реакция е или химичен процес (да речем, разпадането на една молекула или сблъсъкът на две частици), или преходът на частица към възбудено състояние (или, обратно, нейният преход от възбудено към основно или слабо възбудено състояние).
Дори привидно проста реакция
напредва на етапи, като всеки етап протича със собствено темпо.
1-ви етап (бърз):
![]()
2-ри етап (сравнително бавен):
Спомнете си кои частици се наричат радикали. Какви реакции се наричат верижни реакции и каква е енергията на активиране?
Съвкупността от елементарни етапи на химическа реакция, следващи един след друг (т.е. последователно) или протичащи успоредно, се нарича механизъмхимическа реакция. Механизмите на реакцията са различни.
За химика е много важно да знае какви фактори определят скоростта на химичната реакция. Особено важна е зависимостта на скоростта на реакцията (или нейните етапи) от концентрациите на реагентите. Тази зависимост се нарича кинетично уравнение. За хипотетична реакция aA + bB = dD + eE, математическият израз (кинетично уравнение) има формата
![]()
където V е скоростта на химичната реакция; c е концентрацията на веществото, mol/l; a, b - експоненти (тези стойности се определят експериментално). Коефициентът на пропорционалност k в кинетичното уравнение се нарича скоростна константахимическа реакция. Числено е равна на скоростта на химична реакция при концентрации на реагентите, равни на 1 mol/L.
Скоростта на елементарните етапи на реакцията е пропорционална на произведението на концентрациите на реагентните частици, например:
Скоростта на общата реакция може да варира, понякога по много сложен начин, в зависимост от концентрацията на реагентите.
По този начин превръщането на едни вещества в други не е еднократно събитие, а процес, който се развива във времето, тоест има своя собствена времева структура, която се изразява в механизма на реакцията. В същото време механизмът на реакцията отчита не само промените в състава на веществата, участващи в реакцията, но и промените в позициите на атомите в пространството по време на реакцията. Следователно можем да говорим за пространствено-времева структура на реакцията.
Развитието на химичната кинетика, областта на химията, която изучава скоростите и механизмите на химичните реакции, започва през втората половина на 19 век. Основите на тази дисциплина са положени през 1880 г. Холандският физикохимик Якоб ван'т Хоф и шведският учен Сванте Арениус.
КАТАЛИЗА. Отдавна е отбелязано, че някои вещества са способни значително да увеличат скоростта на химичната реакция, въпреки че самите те не променят своята химичен състав. Такива вещества се наричат катализатори. Например, водородният пероксид се разлага бавно при стайна температура: 2H 2 0 2 \u003d 2H 2 0 + 0 2. В присъствието на платина скоростта на нейното разграждане се увеличава повече от 2000 пъти, а ензимът каталаза (намиращ се в кръвта) увеличава скоростта на реакцията с 90 милиарда пъти!
Катализаторът не се изразходва в химическия процес. Той се включва в междинните етапи на процеса и се регенерира в самия край. Следователно самото уравнение на реакцията не го включва.
Светът на катализаторите е широк и разнообразен, както и начините им на действие. Но като цяло може да се каже, че катализаторът, включвайки се в механизма на реакцията, го променя и насочва процеса по енергийно по-изгоден път. В същото време, което е особено важно, катализаторите могат да предизвикат такива процеси да се появят със забележима скорост, която практически не се случва без тях.
Всеки катализатор може да ускори само определени видове реакции, а в някои случаи само определени реакции. Тази характеристика на катализаторите се нарича селективност (селективност). Селективността на действието на катализаторите позволява да се получи само определен желан продукт по определен начин: да се „насочи“ действието на лекарството и т.н. Биологичните катализатори се отличават с най-висока селективност и ефективност - ензимикоито катализират биохимичните реакции в живите организми.
Има вещества, които забавят или дори спират химичните процеси. Те се наричат инхибитори. Въпреки това, за разлика от катализаторите, инхибиторите се изразходват по време на реакцията.
- От какви фактори зависят скоростите на химичните реакции?
- Може ли скоростта на всяка реакция да бъде пропорционална на квадрата на концентрацията на което и да е вещество? Ако да, моля, дайте примери.
- Предложете хипотеза, обясняваща защо, за разлика от катализаторите, инхибиторите се изразходват по време на реакцията.
1. Какво се нарича скорост на химична реакция? В какви единици се измерва? От какви фактори зависи?
2. Сравнете понятията "скорост на движение" и "скорост на химическа реакция". Какво общо имат? 
3. Какви две класификации на реакциите според агрегатното състояние на реагентите и според участието на катализатора в тях можете да предложите? Дайте примери за такива реакции, запишете техните уравнения. 
4. Формулирайте закона за действието на масите. За какви реакции се отнася? 
5. Формулирайте закона на Вант Хоф.
6. Какво представляват катализаторите? На какви групи могат да бъдат разделени? Къде инхибиторите могат да се използват най-ефективно? 
7. Какво представляват ензимите? Сравнете ги с неорганични катализатори. Избройте употребите на ензимите. 
8. Защо има бурно „кипене“ на водороден прекис при лечение на порязвания и други рани?
9. Сухият хлор се съхранява в железни цилиндри. Мокрият хлор разрушава желязото. Каква е ролята на водата в този процес?
10. Вземат се вещества за реакцията при температура 40°C. След това се нагряват до температура от 70°C. Как ще се промени скоростта на химична реакция, ако нейният температурен коефициент е 2? 
11. Напишете уравнение, което отразява закона за масово действие за реакции, чиито уравнения са:
а) 2NO+O₂↔2NO₂;
б) I₂+H₂↔2HI 
12. Защо храните се съхраняват в хладилници? 
Какво е вискозитет и от какви фактори зависи? В какви единици се измерва вискозитетът?
вискозитет- едно от явленията на пренос, свойството на течните тела (течности и газове) да се съпротивляват на движението на една от техните части спрямо друга. В резултат на това работата, изразходвана за това движение, се разсейва под формата на топлина.
Механизмът на вътрешното триене в течности и газове се крие във факта, че произволно движещите се молекули прехвърлят инерция от един слой в друг, което води до изравняване на скоростите - това се описва чрез въвеждането на сила на триене.
Вискозитетът зависи от състава и структурата на течността, както и от температурата и налягането. За да се вземе предвид влиянието на състава, е необходимо да се избере обща температура за сравняване на течности. Поради разнообразния температурен диапазон на тяхното съществуване и различната зависимост на вискозитета на течностите от температурата е невъзможно и трудно да се намери такава температура за всички течности, дори и за течности с подобен състав.
Разграничете динамичния вискозитет (единица в международна системаединици (SI) - Pa s, в системата CGS - poise; 1 Pa s = 10 поаза) и кинематичен вискозитет (единица SI - m/s, CGS - стокс, извънсистемна единица - градус на Енглер). Кинематичният вискозитет може да се получи като съотношението на динамичния вискозитет към плътността на веществото и дължи произхода си на класическите методи за измерване на вискозитета, като например измерване на времето, необходимо на даден обем да изтече през калибриран отвор под въздействието на гравитацията . Устройство за измерване на вискозитет се нарича вискозиметър.