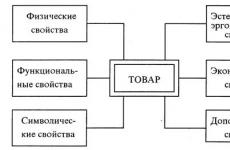
Mida nimetatakse keemilise reaktsiooni kiiruseks milles. Mis on keemilise reaktsiooni kiiruskonstant? Reaktsioonikiirust mõjutavad tegurid
Kõik liigutused on katkematu ahel
vorm Ja tekivad üks
teine teadaolevas järjekorras.
Lucretius
Mis on mehhanism keemiline reaktsioon? Mis on reaktsiooni kineetiline võrrand ja mis on selle tähendus? Mis on katalüsaatori toimemehhanism? Mis on inhibiitorid?
Tund-loeng
KEEMILINE REAKTSIOON LIIKUMISE NÄITEKS. Pidage meeles, milline on keemilise reaktsiooni kiirus ja millistest teguritest see sõltub.
Keemilised reaktsioonid kulgevad erineva kiirusega. Nende kiiruste vahemik on äärmiselt lai - alates peaaegu hetkelistest reaktsioonidest (plahvatus, palju reaktsioone lahustes) kuni äärmiselt aeglasteni, mis võtavad aega sajandeid (näiteks pronksi oksüdeerumine õhus).
Graveerimine. Alkeemikud
19. sajandil leiti, et valdav enamus keemilistest reaktsioonidest on mitmeetapilised protsessid, st need ei toimu mitte reagendi osakeste otsesel samaaegsel kokkupõrkel produktide moodustumisega, vaid rea lihtsate (elementaar)protsesside kaudu. Tõepoolest, kui näiteks ammoniaagi oksüdatsioonireaktsioon kulgeks ühes etapis, nõuaks see tohutuid energiakulusid ammoniaagi ja hapniku molekulide sidemete samaaegseks katkestamiseks. Lisaks on kolme osakese kokkupõrke tõenäosus väga väike, neli - peaaegu võrdne nulliga. Seitsme osakese (neli ammoniaagi molekuli ja kolme hapnikumolekuli) samaaegne kokkupõrge on lihtsalt võimatu.
Keemilise reaktsiooni iga elementaarne etapp on kas keemiline protsess (näiteks ühe molekuli lagunemine või kahe osakese kokkupõrge) või osakese üleminek ergastatud olekusse (või vastupidi, selle üleminek ergastatud olekust olekusse). maandatud või madala ergutusega olek).
Isegi pealtnäha lihtne reaktsioon
edeneb etappidena, iga etapp kulgeb omas tempos.
1. etapp (kiire):
![]()
2. etapp (suhteliselt aeglane):
Pidage meeles, milliseid osakesi nimetatakse radikaalideks. Milliseid reaktsioone nimetatakse ahelreaktsioonideks ja mis on aktiveerimisenergia?
Üksteisele järgnevate (s.t järjestikku) või paralleelselt toimuvate keemilise reaktsiooni elementaarsete etappide kogumit nimetatakse mehhanism keemiline reaktsioon. Reaktsioonimehhanismid on erinevad.
Keemiku jaoks on väga oluline teada, millised tegurid määravad keemilise reaktsiooni kiiruse. Eriti oluline on reaktsioonikiiruse (või selle etappide) sõltuvus reagentide kontsentratsioonidest. Seda sõltuvust nimetatakse kineetiline võrrand. Hüpoteetilise reaktsiooni aA + bB = dD + eE korral on matemaatilisel avaldisel (kineetilisel võrrandil) vorm
![]()
kus V on keemilise reaktsiooni kiirus; c on aine kontsentratsioon, mol/l; a, b - eksponendid (need väärtused määratakse eksperimentaalselt). Nimetatakse kineetilises võrrandis proportsionaalsuse kordajat k kiiruskonstant keemiline reaktsioon. See on arvuliselt võrdne keemilise reaktsiooni kiirusega, kui reagentide kontsentratsioon on 1 mol/L.
Reaktsiooni elementaarsete etappide kiirus on võrdeline reageerivate osakeste kontsentratsioonide korrutisega, näiteks:
Üldreaktsiooni kiirus võib varieeruda, mõnikord väga keeruliselt, sõltuvalt reaktiivide kontsentratsioonist.
Seega ei ole ühtede ainete teisenemine teisteks ühekordne sündmus, vaid protsess, mis rullub lahti ajas ehk sellel on oma ajaline struktuur, mida väljendab reaktsioonimehhanism. Samas ei võta reaktsioonimehhanism arvesse mitte ainult reaktsioonis osalevate ainete koostise muutusi, vaid ka aatomite positsioonide muutumist ruumis reaktsiooni kulgedes. Seetõttu saame rääkida reaktsiooni ruumilis-ajalisest struktuurist.
Keemilise kineetika, keemia valdkonna, mis uurib keemiliste reaktsioonide kiirusi ja mehhanisme, areng algas 19. sajandi teisel poolel. Sellele distsipliinile pandi alus 1880. aastatel. Hollandi füüsikaline keemik Jacob van't Hoff ja Rootsi teadlane Svante Arrhenius.
KATALÜÜS. Pikka aega on täheldatud, et mõned ained on võimelised märkimisväärselt suurendama keemilise reaktsiooni kiirust, kuigi nad ise oma omadusi ei muuda. keemiline koostis. Selliseid aineid nimetatakse katalüsaatorid. Näiteks laguneb vesinikperoksiid toatemperatuuril aeglaselt: 2H 2 0 2 \u003d 2H 2 0 + 0 2. Plaatina juuresolekul suureneb selle lagunemise kiirus rohkem kui 2000 korda ja katalaasi ensüüm (veres leiduv) suurendab reaktsiooni kiirust 90 miljardit korda!
Katalüsaatorit keemilises protsessis ei kasutata. See sisaldub protsessi vaheetappides ja taastub päris lõpus. Seetõttu reaktsioonivõrrand ise seda ei hõlma.
Katalüsaatorite maailm on lai ja mitmekesine, nagu ka nende toimeviisid. Aga üldiselt võib öelda, et reaktsioonimehhanismi kaasatuna katalüsaator muudab seda ja suunab protsessi energeetiliselt soodsamat teed pidi. Samal ajal, mis on eriti oluline, võivad katalüsaatorid põhjustada selliseid protsesse märgatava kiirusega, mida ilma nendeta praktiliselt ei toimu.
Iga katalüsaator võib kiirendada ainult teatud tüüpi reaktsioone ja mõnel juhul ainult teatud reaktsioone. Seda katalüsaatorite omadust nimetatakse selektiivsuseks (selektiivsus). Katalüsaatorite toime selektiivsus võimaldab saada ainult teatud soovitud produkti teatud viisil: "suunata" ravimi toimet jne. Bioloogilised katalüsaatorid eristuvad kõrgeima selektiivsuse ja efektiivsuse poolest. ensüümid mis katalüüsivad elusorganismide biokeemilisi reaktsioone.
On aineid, mis aeglustavad või isegi peatavad keemilisi protsesse. Neid nimetatakse inhibiitorid. Kuid erinevalt katalüsaatoritest tarbitakse reaktsiooni käigus inhibiitoreid.
- Millistest teguritest sõltuvad keemiliste reaktsioonide kiirus?
- Kas mis tahes reaktsiooni kiirus võib olla võrdeline mis tahes aine kontsentratsiooni ruuduga? Kui jah, siis tooge näiteid.
- Pakkuge välja hüpotees, mis selgitab, miks erinevalt katalüsaatoritest tarbitakse reaktsiooni käigus inhibiitoreid.
1. Mida nimetatakse keemilise reaktsiooni kiiruseks? Millistes ühikutes seda mõõdetakse? Millistest teguritest see sõltub?
2. Võrrelge mõisteid "liikumiskiirus" ja "keemilise reaktsiooni kiirus". Mis neil ühist on? 
3. Millised kaks reaktsioonide klassifikatsiooni vastavalt reagentide agregatsiooni olekule ja katalüsaatori osalusele nendes oskate välja pakkuda? Tooge näiteid selliste reaktsioonide kohta, kirjutage üles nende võrrandid. 
4. Sõnasta massitegevuse seadus. Milliste reaktsioonide puhul see kehtib? 
5. Sõnasta Van't Hoffi seadus.
6. Mis on katalüsaatorid? Millistesse rühmadesse saab neid jagada? Kus saab inhibiitoreid kõige tõhusamalt kasutada? 
7. Mis on ensüümid? Võrrelge neid anorgaaniliste katalüsaatoritega. Loetlege ensüümide kasutusalad. 
8. Miks toimub lõikehaavade ja muude haavade ravimisel vesinikperoksiidi äge "keemine"?
9. Kuiva kloori hoitakse raudsilindrites. Märg kloor hävitab rauda. Millist rolli mängib vesi selles protsessis?
10. Reaktsiooni ained võeti temperatuuril 40 °C. Seejärel kuumutati need temperatuurini 70 °C. Kuidas muutub keemilise reaktsiooni kiirus, kui selle temperatuuritegur on 2? 
11. Kirjutage üles võrrand, mis peegeldab massimõju seadust reaktsioonide jaoks, mille võrrandid on järgmised:
a) 2NO+O2↔2NO2;
b) I2+H2↔2HI 
12. Miks toiduaineid külmkapis hoitakse? 
Mis on viskoossus ja millistest teguritest see sõltub? Millistes ühikutes mõõdetakse viskoossust?
viskoossus- üks ülekande nähtustest, vedelate kehade (vedelike ja gaaside) omadus seista vastu ühe nende osa liikumisele teise suhtes. Selle tulemusena hajub sellele liikumisele kulutatud töö soojuse kujul.
Vedelike ja gaaside sisehõõrdemehhanism seisneb selles, et juhuslikult liikuvad molekulid kannavad hoogu ühest kihist teise, mis viib kiiruste joondumiseni – seda kirjeldab hõõrdejõu sisseviimine.
Viskoossus oleneb vedeliku koostisest ja struktuurist, samuti temperatuurist ja rõhust. Kompositsiooni mõju arvessevõtmiseks on vaja vedelike võrdlemiseks valida ühine temperatuur. Nende olemasolu mitmekesise temperatuurivahemiku ja vedelike viskoossuse erineva sõltuvuse tõttu temperatuurist on võimatu ja raske leida sellist temperatuuri kõikidele vedelikele isegi sarnase koostisega vedelike jaoks.
Eristage dünaamilist viskoossust (ühik sisse rahvusvaheline süsteemühikud (SI) - Pa s, CGS-süsteemis - poise; 1 Pa s = 10 poise) ja kinemaatiline viskoossus (SI ühik - m/s, CGS - stokes, süsteemiväline ühik - Engleri kraad). Kinemaatilise viskoossuse võib saada dünaamilise viskoossuse ja aine tiheduse suhtena ning selle päritolu on klassikaliste viskoossuse mõõtmise meetoditega, nagu näiteks aja mõõtmine, mis kulub antud ruumala voolamiseks läbi kalibreeritud ava raskusjõu mõjul. . Viskoossuse mõõtmise seadet nimetatakse viskosimeetriks.